网址:http://m.1010jiajiao.com/timu3_id_415734[举报]
①准确称量3.920 g晶体溶于适量的稀硫酸中,配成100 mL浅绿色溶液X。
②取少量X于试管中滴入KSCN溶液,无现象,再滴入氯水,溶液呈红色。
③取少量X于试管中加入浓NaOH溶液,加热,生成的气体能使湿润的红色石蕊试纸变蓝。
④取出20.00 mLX于锥形瓶中,用0.020 mol·L-1KMnO4溶液滴定(不需要指示剂),当到达终点时,用去KMnO4溶液20.00 mL。
⑤再取20.00 mLX加入足量浓NaOH溶液,加热,生成的气体恰好被20 mL0.10 mol·L-1 H2SO4溶液完全吸收(生成正盐)。
⑥另取20.00 mLX向其中加入足量的BaCl2溶液,将沉淀过滤、洗涤、烘干、称量得1.00 g。
(提示:酸性KMnO4被还原成Mn2+,Mn2+在稀溶液中几乎呈无色)
试回答下列有关问题:
(1)A中所含的阳离子是_________;所含的阴离子为_________。
(2)把A溶于稀硫酸而不直接溶于水的主要原因是__________________
(3)第④操作中,对滴定管的使用主要有以下几步:
a.用特制洗涤液洗涤;b.用自来水冲洗后,用蒸馏水洗涤;c.再用_________润洗两次;d.装入标准液后,_________;e.调节标准溶液的液面在“0”或“0”刻度以下,固定在滴定架上。
(4)此实验的名称_________。
(5)此方案设计中有一步操作失误(此步操作在实验中无意义),它是第_________ (填编号),此步实验应如何设计?
(6)如果通过实验测得3.920 g晶体中含有的阴离子全部形成钡盐沉淀的质量为4.66 g,则A的化学式为_________。
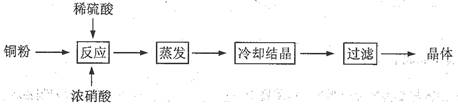
查看习题详情和答案>>(13分) CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。
根据题意完成下列填空:
(1)向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象: 、 。
(2)有同学认为此种方法会生成有毒的氮的氧化物, 且所得晶体可能混有硝酸铜。建议将浓硝酸换成其它氧化剂,你觉得呢?若有同感,请选择合适的试剂完成下列反应(若有反应条件的应注明):
__Cu + __H2SO4 + __________→ __CuSO4 +_______________
(3)已知:CuSO4+2NaOH=Cu(OH)2↓+ Na2SO4
相对分子质量:CuSO4:160 H2O:18
称取0.1000 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L盐酸滴定至终点,耗用盐酸20.16 mL,则该试样中含CuSO4·5H2O的质量分数为 。
(4)上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用 。
(5)如果采用重量法测定CuSO4·5H2O的含量,完成下列步骤:
①称取样品a g②加水溶解③加氯化钡溶液,沉淀④过滤、 、干燥⑤称量所得固体b g。
在过滤前,需要检验是否沉淀完全,其操作是
则a g该试样中含CuSO4·5H2O的质量为 g (用含b的代数式表示)。
[相对原子质量:H-1 O-16 S-32 Ba-137]
根据题意完成下列填空:
(1)向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象: 、 。
(2)有同学认为此种方法会生成有毒的氮的氧化物, 且所得晶体可能混有硝酸铜。建议将浓硝酸换成其它氧化剂,你觉得呢?若有同感,请选择合适的试剂完成下列反应(若有反应条件的应注明):
__Cu + __H2SO4 + __________→ __CuSO4 +_______________
(3)已知:CuSO4+2NaOH=Cu(OH)2↓+ Na2SO4
相对分子质量:CuSO4:160 H2O:18
称取0.1000 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L盐酸滴定至终点,耗用盐酸20.16 mL,则该试样中含CuSO4·5H2O的质量分数为 。
(4)上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用 。
(5)如果采用重量法测定CuSO4·5H2O的含量,完成下列步骤:
①称取样品a g②加水溶解③加氯化钡溶液,沉淀④过滤、 、干燥⑤称量所得固体b g。
在过滤前,需要检验是否沉淀完全,其操作是
则a g该试样中含CuSO4·5H2O的质量为 g (用含b的代数式表示)。
[相对原子质量:H-1 O-16 S-32 Ba-137]
CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。
根据题意完成下列填空:
⑴向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象: 、 。
⑵如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4·5H2O中可能存在的杂质是 ,除去这种杂质的实验操作称为 。
⑶已知:CuSO4+2NaOH=Cu(OH)2↓+ Na2SO4
称取0.1000 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L盐酸滴定至终点,耗用盐酸20.16 mL,则0.1000 g该试样中含CuSO4·5H2O g。
⑷上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用 。
在滴定中,准确读数应该是滴定管上蓝线 所对应的刻度。
⑸如果采用重量法测定CuSO4·5H2O的含量,完成下列步骤:
① ②加水溶解③加氯化钡溶液,沉淀④过滤(其余步骤省略)
在过滤前,需要检验是否沉淀完全,其操作是
⑹如果1.040 g提纯后的试样中含CuSO4·5H2O的准确值为1.015 g,而实验测定结果是l.000 g 测定的相对误差为 。
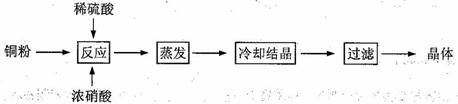
查看习题详情和答案>>CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。

根据题意完成下列填空:
⑴向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象: 、 。
⑵如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4·5H2O中可能存在的杂质是 ,除去这种杂质的实验操作称为 。
⑶已知:CuSO4+2NaOH=Cu(OH)2↓+ Na2SO4
称取0.1000 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L盐酸滴定至终点,耗用盐酸20.16 mL,则0.1000 g该试样中含CuSO4·5H2O g。
⑷上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用 。
在滴定中,准确读数应该是滴定管上蓝线 所对应的刻度。
⑸如果采用重量法测定CuSO4·5H2O的含量,完成下列步骤:
① ②加水溶解③加氯化钡溶液,沉淀④过滤(其余步骤省略)
在过滤前,需要检验是否沉淀完全,其操作是
⑹如果1.040 g提纯后的试样中含CuSO4·5H2O的准确值为1.015 g,而实验测定结果是l.000 g 测定的相对误差为 。
查看习题详情和答案>>