网址:http://m.1010jiajiao.com/timu3_id_415192[举报]
下列说法中,正确的是( )
| A.在Na[Al(OH)4]溶液中,Al3+可能大量存在 |
| B.向Ca(ClO)2溶液中通入二氧化硫,反应的离子方程式为: Ca2+ + 2ClO- + H2O + SO2 ═CaSO3↓+ 2HClO |
| C.在由水电离出的c(OH-)=1×10-12mol·L-1的溶液中,Al3+不可能大量存在 |
| D.室温下pH=6的酸性溶液中,可能存在NH3·H2O分子 |
| A.在Na[Al(OH)4]溶液中,Al3+可能大量存在 |
| B.向Ca(ClO)2溶液中通入二氧化硫,反应的离子方程式为: Ca2+ + 2ClO- + H2O + SO2 ═CaSO3↓+ 2HClO |
| C.在由水电离出的c(OH-)=1×10-12mol·L-1的溶液中,Al3+不可能大量存在 |
| D.室温下pH=6的酸性溶液中,可能存在NH3·H2O分子 |
|
室温时有以下三种溶液:a、Ba(OH)2 b、NaOH c、NH3·H2O下列说法正确的是 | |
| [ ] | |
A. |
同物质的量浓度的三种溶液的pH:a=b>c |
B. |
同pH的三种溶液稀释相同倍数后,pH:a=b<c |
C. |
中和同pH、同体积的三种溶液消耗同物质的量浓度的盐酸的体积:a=b=c |
D. |
同pH的三种溶液稀释不同的倍数,pH仍相同,则三种溶液稀释的倍数:a>b>c |
| A.在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 |
| B.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) |
C.室温下向10 mL pH=3的醋酸溶液中加水稀释,溶液中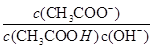 不变 不变 |
| D.在0.1 mol·L-1的硫化钠溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
为《京都议定书》2012年第一承诺期到期后的温室气体减排问题,世界各国都做出了不同的努力.随着新能源的开发和利用,CH3OH这个物质逐渐进入人们的视野,越来越受到人们的关注.
(1)下图是由CO(g)+2H2(g)→CH3OH(g)进行过程中的能量变化曲线.曲线a表示不使用催化剂时反应的能量变化,曲线b表示.下列相关说法正确的是_______
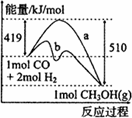
A.该反应是吸热反应
B.使用催化剂后反应热减小
C.热化学方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH=-510 kJ/mol
CH3OH(g) ΔH=-510 kJ/mol
D.热化学方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH=-91 kJ/mol
CH3OH(g) ΔH=-91 kJ/mol
(2)由(1)推断,CO(g)+2H2(g)![]() CH3OH(g)在密闭容器中进行,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可采取的措施是_______
CH3OH(g)在密闭容器中进行,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可采取的措施是_______
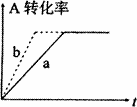
A.增大CO的浓度
B.缩小容器的容积
C.加入催化剂
D.升高温度
(3)由甲醇和氧气以及强碱做电解质溶液的新型燃料电池,正在逐步推广使用,假定放电过程中,甲醇完全氧化产生二氧化碳被充分吸收生成CO32-.该电池的负极反应的离子方程式为_________,放电过程中电池里溶液的pH将_________(填“下降”、“上升”或“不变”);若有16克甲醇被完全氧化产生电能,并利用该过程中释放的电能电解足量的硫酸铜溶液,假设能量的利用率为80%.则得到氧气的物质的量是_________.
(4)某同学将甲醇完全燃烧生成CO2气体通入200 mL 0.1 mol/L的石灰水后,得到1 g沉淀,那么通入的CO2的体积可能为(标态)_________.