摘要:一定量Na2O2和NaHCO3固体混合后.在密闭容器中加热充分反应.排出气体物质后冷却.残留固体物质下表中不正确的是: Na2O2/mol NaHCO3/mol 残留的固体物质 A 1 2 Na2CO3 B 1.5 2 Na2O2 Na2CO3 C 2 1 Na2O2 NaOH NaHCO3 D 2 2 NaOH Na2CO3 第II卷 非选择题
网址:http://m.1010jiajiao.com/timu3_id_415156[举报]
 Ⅰ将a mol的Na2O2和bmol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应,假设NaHCO3分解产生的CO2与Na2O2反应完后,H2O再与Na2O2反应.
Ⅰ将a mol的Na2O2和bmol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应,假设NaHCO3分解产生的CO2与Na2O2反应完后,H2O再与Na2O2反应.
(1)当剩余固体只有Na2CO3,排出气体中O2的物质的量为______(用含a或b的代数式表示)
(2)当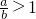 时,剩余固体是______,排出气体是______.
时,剩余固体是______,排出气体是______.
(3)当剩余固体为Na2CO3,NaOH,排出气体为O2,H2O时,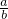 的值为______.
的值为______.
(4)当排出的O2和H2O为等物质的量时,则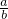 的值为______.
的值为______.
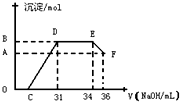
Ⅱ实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0).试回答下列问题:
(1)写出反应过程中的离子反应方程式:
DE段______,
EF段______.
(2)合金中,铝的质量为______g,铁的质量为______g.
(3)硝酸溶液的物质的量浓度为______mol?L-1
(4)C的值为______mL.
查看习题详情和答案>>
Ⅰ将a mol的Na2O2和bmol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应,假设NaHCO3分解产生的CO2与Na2O2反应完后,H2O再与Na2O2反应.
(1)当剩余固体只有Na2CO3,排出气体中O2的物质的量为______(用含a或b的代数式表示)
(2)当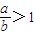 时,剩余固体是______,排出气体是______.
时,剩余固体是______,排出气体是______.
(3)当剩余固体为Na2CO3,NaOH,排出气体为O2,H2O时,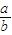 的值为______.
的值为______.
(4)当排出的O2和H2O为等物质的量时,则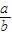 的值为______.
的值为______.
Ⅱ实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0).试回答下列问题:
(1)写出反应过程中的离子反应方程式:
DE段______,
EF段______.
(2)合金中,铝的质量为______g,铁的质量为______g.
(3)硝酸溶液的物质的量浓度为______mol?L-1
(4)C的值为______mL.
 查看习题详情和答案>>
查看习题详情和答案>>
(1)当剩余固体只有Na2CO3,排出气体中O2的物质的量为______(用含a或b的代数式表示)
(2)当
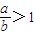 时,剩余固体是______,排出气体是______.
时,剩余固体是______,排出气体是______.(3)当剩余固体为Na2CO3,NaOH,排出气体为O2,H2O时,
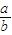 的值为______.
的值为______.(4)当排出的O2和H2O为等物质的量时,则
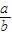 的值为______.
的值为______.Ⅱ实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0).试回答下列问题:
(1)写出反应过程中的离子反应方程式:
DE段______,
EF段______.
(2)合金中,铝的质量为______g,铁的质量为______g.
(3)硝酸溶液的物质的量浓度为______mol?L-1
(4)C的值为______mL.
 查看习题详情和答案>>
查看习题详情和答案>>
 (2012?长宁区一模)Ⅰ将a mol的Na2O2和bmol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应,假设NaHCO3分解产生的CO2与Na2O2反应完后,H2O再与Na2O2反应.
(2012?长宁区一模)Ⅰ将a mol的Na2O2和bmol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应,假设NaHCO3分解产生的CO2与Na2O2反应完后,H2O再与Na2O2反应.(1)当剩余固体只有Na2CO3,排出气体中O2的物质的量为
| a |
| 2 |
| a |
| 2 |
(2)当
| a |
| b |
Na2CO3、NaOH、Na2O2
Na2CO3、NaOH、Na2O2
,排出气体是排出气体为O2
排出气体为O2
.(3)当剩余固体为Na2CO3,NaOH,排出气体为O2,H2O时,
| a |
| b |
| 1 |
| 2 |
| a |
| b |
| 1 |
| 2 |
| a |
| b |
(4)当排出的O2和H2O为等物质的量时,则
| a |
| b |
| 2 |
| 3 |
| 2 |
| 3 |
Ⅱ实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0).试回答下列问题:
(1)写出反应过程中的离子反应方程式:
DE段
NH4++OH-=NH3?H2O
NH4++OH-=NH3?H2O
,EF段
Al(OH)3+OHˉ=AlO2ˉ+2H2O
Al(OH)3+OHˉ=AlO2ˉ+2H2O
.(2)合金中,铝的质量为
0.216
0.216
g,铁的质量为1.344
1.344
g.(3)硝酸溶液的物质的量浓度为
1.48
1.48
mol?L-1(4)C的值为
7
7
mL.