摘要:17.(江苏省江浦高级中学高三化学2010第一轮复习模块检测)一定温度下.将2mol PCl3和 1mol Cl2充入容积不变的密闭容器中.在一定条件下反应:PCl3+Cl2 PCl5.各物质均为气态.达平衡后.PCl5为0.4mol.若此时再移走1mol PCl3 和0.5mol Cl2.相同温度下达到平衡.PCl5的物质的量为: A.0.4mol B.0.2mol C.0.2<x<0.4mol D.<0.2mol
网址:http://m.1010jiajiao.com/timu3_id_414856[举报]
甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ?mol-1
(1)一定温度下,将2mol CO和一定量H2充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是 .
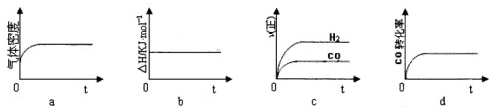
若在相同温度下,上述反应改在体积为2L的恒容密闭容器中进行,平衡常数 (填“增大”“不变”或“减小”);反应10s后CO的物质的量为l.2mol,则0~10s的平均反应速率v(H2)= .
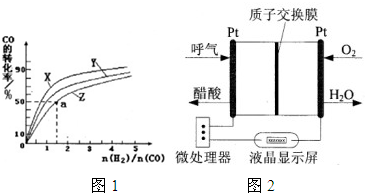
(2)在容积为2L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律.如图1是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为2mol)与CO平衡转化率的关系.
请回答:
①在上述三种温度中,曲线X对应的是 .
②利用图1中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)?CH3OH(g)的平衡常数K= .
(3)已知:CO(g)+
O2(g)=CO2(g);△H2=-283kJ?mol-1
H2(g)+
O2(g)=H2O(g)△H3=-242kJ?mol-1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为 ;
(4)乙醇燃料电池具有很高的实用价值.如图2所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.则该电池的负极反应式为 .
查看习题详情和答案>>
(1)一定温度下,将2mol CO和一定量H2充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是

若在相同温度下,上述反应改在体积为2L的恒容密闭容器中进行,平衡常数

(2)在容积为2L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律.如图1是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为2mol)与CO平衡转化率的关系.
请回答:
①在上述三种温度中,曲线X对应的是
②利用图1中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)?CH3OH(g)的平衡常数K=
(3)已知:CO(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为
(4)乙醇燃料电池具有很高的实用价值.如图2所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.则该电池的负极反应式为
在一定温度下,将2mol A和2mol B两种气体相混合于体积为2L的某密闭容器中(容积不变),发生如下反应:3A(g)+B(g)
xC(g)+2D(g),△H<0,到2min末反应达到平衡状态(温度不变),生成了0.8mol D,并测得C的浓度为0.4mol?L-1,请填写下列空白:
(1)x的值等于
(2)该反应的化学平衡常数K=
(3)A物质的转化率为
(4)若维持温度不变,在原平衡混合物的容器中再充入3mol C和3mol D,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入B的物质的量为
查看习题详情和答案>>
xC(g)+2D(g),△H<0,到2min末反应达到平衡状态(温度不变),生成了0.8mol D,并测得C的浓度为0.4mol?L-1,请填写下列空白:
(1)x的值等于
2
2
.(2)该反应的化学平衡常数K=
0.5
0.5
,升高温度时K值将增大
增大
(选填“增大”、“减小”或“不变”).(3)A物质的转化率为
60%
60%
.(4)若维持温度不变,在原平衡混合物的容器中再充入3mol C和3mol D,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入B的物质的量为
3
3
mol.在一定温度下,将2mol SO2和1mol O2充入一定容积的密闭容器中,在催化剂作用下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H=-197kJ?mol-1,当达到化学平衡时,下列说法中正确的是( )
查看习题详情和答案>>
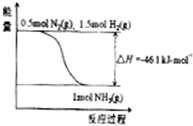 氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下:
氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下:| 温度/℃ | 200 | 300 | 400 | 500 | 600 |
| 氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是
(2)根据图,合成氨的热化学方程式是
(3)在一定温度下,将2mol N2和6mol H2通入到体积为1L的密闭容器中,发生反应N2+3H2?2NH3,2min达到平衡状态时,H2转化率是50%,则用H2表示该反应的平均速率v(H2)=
(4)从化学平衡移动的角度分析,提高H2转化率可以采取的措施是
a.及时分离出NH3 b.升高温度 c.增大压强 d.使用催化剂.
 xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol·L-1,试求:
xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol·L-1,试求: