摘要:7.(江苏省赣榆一中2010届高三12月阶段考试化学)(1)80℃时.将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中.发生如下反应:N2O4 2NO2 △H>0.隔一段时间对该容器内的物质进行分析.得到如下数据: 时间(s) n(mol) 0 20 40 60 80 100 n(N2O4) 0.40 a 0.20 c d e n(NO2) 0.00 0.24 b 0.52 0.60 0.60 ①计算20s-40s内用N2O4表示的平均反应速率为 mol/(L.s) ②计算在80℃时该反应的平衡常数K= , ③反应进行至100s后将反应混合物的温度降低.混合气体的颜色(填“变浅 .“变深 或“不变 ) , ④要增大该反应的K值.可采取的措施有 A.增大N2O4的起始浓度 B.向混合气体中通入NO2 C.使用高效催化剂 D.升高温度 ,②1.8 , ④ D (2)①14HNO3+3Cu2O==6Cu(NO3)2+2NO↑+7H2O ②0.6mol ③使用了较浓的硝酸.产物中有部分二氧化氮生成
网址:http://m.1010jiajiao.com/timu3_id_414845[举报]
所示框图涉及到的物质所含元素中,除一种元素外,其余均为元素周期表中前18号元素.其中A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出).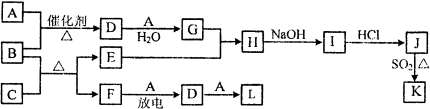
请回答下列问题:
(1)B的电子式为 .
(2)J、K是同种金属的不同氯化物,K为白色沉淀.写出SO2还原J生成K的离子方程式: .
(3)气体B在纯A中燃烧,可生成F和水.科学家利用此原理,设计成B-A燃料电池,则通入气体B的一极是 (填“正极”或“负极”);碱性条件下,该极的电极反应式为 .
(4)在80℃时,将0.80mol气体L充入2L已经抽空的固定容积的密闭容器中发生反应生成M,隔一段时间对该容器内的物质进行分析,得到如表数据:
①计算a= ,此温度时该反应的平衡常数K= ,
②改变条件使反应重新达到平衡,能使c(M)/c(L)值变小的措施有(填字母编号) .
A.增大L的起始浓度 B.升高温度
C.使用高效催化剂 D.向混合气体中通入稀有气体.
查看习题详情和答案>>

请回答下列问题:
(1)B的电子式为
(2)J、K是同种金属的不同氯化物,K为白色沉淀.写出SO2还原J生成K的离子方程式:
(3)气体B在纯A中燃烧,可生成F和水.科学家利用此原理,设计成B-A燃料电池,则通入气体B的一极是
(4)在80℃时,将0.80mol气体L充入2L已经抽空的固定容积的密闭容器中发生反应生成M,隔一段时间对该容器内的物质进行分析,得到如表数据:
| 时间/s | 0 | 30 | 60 | 90 |
| n(L)/mol | 0.80 | a | b | c |
| n(M)/mol | 0.00 | 0.10 | 0.20 | 0.20 |
②改变条件使反应重新达到平衡,能使c(M)/c(L)值变小的措施有(填字母编号)
A.增大L的起始浓度 B.升高温度
C.使用高效催化剂 D.向混合气体中通入稀有气体.
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅.
(1)该反应的化学方程式为
(2)20s时,N2O4的浓度为
(3)该反应的平衡常数表达式K=
,在80℃时该反应的平衡常数K值为
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时
查看习题详情和答案>>
| 时间(s) C(mol/L) |
0 |
20 |
40 |
60 |
80 |
100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
N2O4?2NO2
N2O4?2NO2
,表中b>
>
c(填“<”、“=”、“>”).(2)20s时,N2O4的浓度为
0.14
0.14
mol/L,0~20s内N2O4的平均反应速率为0.003mol/L?s
0.003mol/L?s
.(3)该反应的平衡常数表达式K=
| c2(NO2) |
| c(N2O4) |
| c2(NO2) |
| c(N2O4) |
0.54
0.54
(保留2位小数).(4)在其他条件相同时,该反应的K值越大,表明建立平衡时
ABD
ABD
.A、N2O4的转化率越高 B、NO2的产量越大C、N2O4与NO2的浓度之比越大 D、正反应进行的程度越大.在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅.
(1)该反应的化学方程式为
(2)0~20s内N2O4的平均反应速率为
(3)在80℃时该反应的平衡常数K值为
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时
A、N2O4的转化率越高 B、NO2的转化率越高
C、N2O4与NO2的浓度之比越大 D、正反应进行的程度越大.
查看习题详情和答案>>
| 时间(s) C(mol/L) |
0 |
20 |
40 |
60 |
80 |
100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(1)该反应的化学方程式为
N2O4?2NO2
N2O4?2NO2
,(2)0~20s内N2O4的平均反应速率为
0.003mol/L?s
0.003mol/L?s
.(3)在80℃时该反应的平衡常数K值为
0.54
0.54
(保留2位小数).(4)在其他条件相同时,该反应的K值越大,表明建立平衡时
AD
AD
.A、N2O4的转化率越高 B、NO2的转化率越高
C、N2O4与NO2的浓度之比越大 D、正反应进行的程度越大.
 在80℃时,将0.40mol的N204气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4?2NO2,隔一段时间对该容器内的物质进行分析,得到如下数据:
在80℃时,将0.40mol的N204气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4?2NO2,隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间(s) n(mol) |
0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
0.0020
0.0020
mol?L-1?S-1;(2)计算在80℃时该反应的平衡常数K=
1.8mol?L-1
1.8mol?L-1
(请注明单位).(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”.“变深”或“不变”)
变浅
变浅
;(4)要增大该反应的K值,可采取的措施有(填序号)
D
D
:A.增大N2O4的起始浓度 B.向混合气体中通入NO2 C.使用高效催化剂 D.升高温度
(5)如图是80℃时容器中N204物质的量的变化曲线,请在该图中补画出该反应在60℃时N204物质的量的变化曲线.
80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
①计算20s-40s内用N2O4表示的平均反应速率为
②计算在80℃时该反应的平衡常数K=
③反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”)
④要增大该反应的K值,可采取的措施有(填序号)
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
⑤在同条件下,如果将0.40mol的N2O4气体充入2L已经抽空的固定容积的绝热密闭容器中,最终达到平衡后n(NO2)
查看习题详情和答案>>
| 时间(s) n(mol) |
0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
0.002mol/(L?S)
0.002mol/(L?S)
;②计算在80℃时该反应的平衡常数K=
1.8mol?L-1
1.8mol?L-1
;③反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”)
变浅
变浅
;④要增大该反应的K值,可采取的措施有(填序号)
D
D
.A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
⑤在同条件下,如果将0.40mol的N2O4气体充入2L已经抽空的固定容积的绝热密闭容器中,最终达到平衡后n(NO2)
<
<
0.60mol(填“>”、“<”或“=”).