网址:http://m.1010jiajiao.com/timu3_id_41473[举报]
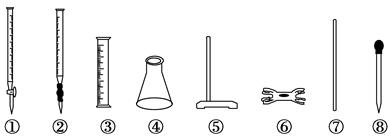
| A.①④⑤⑥ | B.②③⑦⑧ | C.②④⑤⑥ | D.④⑤⑥⑧ |
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]又称莫尔盐,是常用的分析试剂。实验室用FeSO4和(NH4)2SO4两种溶液混合很容易得到莫尔盐晶体。为了确定产品中Fe2+的含量,研究小组用KMnO4(酸化)溶液来滴定莫尔盐溶液中的Fe2+。滴定时必须选用的仪器有 ( )。
| A.①④⑤⑥ | B.②③⑦⑧ | C.②④⑤⑥ | D.④⑤⑥⑧ |
硫酸亚铁铵的化学式为(NH4)2SO4·FeSO4·6H2O,又名莫尔盐,是分析化学中常见的还原剂。某化学研究小组设计如下实验来制备莫尔盐并测定硫酸亚铁铵的纯度。
步骤一:铁屑的处理与称量。在盛有适量铁屑的锥形瓶中加入Na2CO3溶液,加热、过滤、洗涤、干燥、称量,质量记为m1。
步骤二:FeSO4的制备。将上述铁屑加入到一定量的稀硫酸中,充分反应后过滤并用少量热水洗涤锥形瓶和滤纸。滤液及洗涤液完全转移至蒸发皿中。滤渣干燥后称重,质量记为m2。
步骤三:硫酸亚铁铵的制备。准确称取所需质量的(NH4)2SO4加入“步骤二”中的蒸发皿中,缓缓加热一段时间后停止,冷却,待硫酸亚铁铵结晶后过滤。晶体用无水乙醇洗涤并自然干燥,称量所得晶体质量。
步骤四:用比色法测定硫酸亚铁铵的纯度。
回答下列问题:
(1)步骤三中称取的(NH4)2SO4质量为________。
(2)①铁屑用Na2CO3溶液处理的目的是_______________________________。
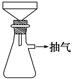
制备FeSO4溶液时,用右图装置趁热过滤,原因是
_______________________________________________________________。
②将(NH4)2SO4与FeSO4混合后加热、浓缩,停止加热的时机是
________________________________________________________________________。
③比色法测定硫酸亚铁铵纯度的实验步骤为:Fe3+标准色阶的配制、待测硫酸亚铁铵溶液的配制、比色测定。标准色阶和待测液配制时除均需加入少量稀盐酸外,还应注意的问题是________________________________________________________________________。
④该实验最终通过____________________确定硫酸亚铁铵产品等级。
查看习题详情和答案>>
(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是
证明溶液A不含Fe3+离子的最佳试剂是
a.酚酞溶液 b.KSCN溶液 c.烧碱溶液 d.KMnO4溶液
操作I的步骤是:加热蒸发、
(2)浓度均为0.1mol?L-1莫尔盐溶液和(NH4)2SO4溶液,c(NH4+)前者大于后者,原因是
(3)用托盘天平称量(NH4)2SO4晶体,晶体要放在天平
(4)从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a接

将装置C中两种液体分离开的操作名称是
(1)预测现象:向盛有莫尔盐溶液的大试管中滴加浓NaOH溶液,并不断振荡.
(2)为了确定产品中亚铁含量,研究小组经查阅资料后,打算用KMnO4(酸化)溶液滴定莫尔盐溶液中的Fe2+.离子方程式为:5Fe2++MnO4-+8H+=5Fe2++Mn2++4H2O.滴定时必须选用的仪器有

(3)取莫尔盐产品23.520g,配成250mL溶液,取出25.00mL用0.0500mol/LKMnO4溶液滴定,消耗KMnO4溶液19.50mL,则产品中莫尔盐的质量分数