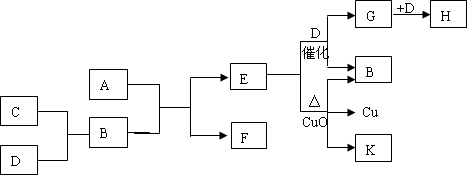
摘要:10.(江苏金陵中学高三年级期中考试题--化学)A为甲.乙两种短周期元素组成的化合物.其摩尔质量为100g·mol-1.甲元素的原子最外层电子数与K层电子数相等.E在通常状况下为气体.其水溶液显碱性.K为乙元素的单质.C为单质.其原子在周期表中半径最小.D为气体.对空气的相对密度为1.103.在适当条件下.它们相互之间有如下图所示的转化关系: 试填写下列空白: (1)甲元素的单质在空气中燃烧除得到A外.还可得到 .物质F的电子式为 . (2)反应“E+D→G+B 的化学方程式为 .它是 工业中的重要反应之一. (3)C和D在一定条件下还能形成另一种化合物I.I是 分子.它能与一种弱酸反应生成强酸.该反应的离子方程式为 .
网址:http://m.1010jiajiao.com/timu3_id_414386[举报]
| |||||||||||||||
①②③④⑤五种元素,在元素周期表中的位置如图所示.回答下列问题
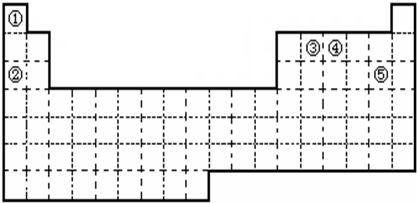
(1)①②③④⑤五种元素中,金属性最强的元素是
(2)元素②的最高价氧化物对应的水化物的电子式为
 ,试比较②和③原子半径的大小②
,试比较②和③原子半径的大小②
(3)画出元素④的原子结构示意图
 ,该元素的最高价氧化物的水化物能与Cu发生反应,反应中作氧化剂的是(写化学式)
,该元素的最高价氧化物的水化物能与Cu发生反应,反应中作氧化剂的是(写化学式)
(4)写出元素⑤在周期表中的位置
(5)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外L层电子数是M层电子数的4倍.
①甲、乙元素分别为
②写出②的最高价氧化物对应的水化物与甲的最高价氧化物反应的离子方程式
(6)已知破坏1mol N≡N键、H-H键、N-H键分别需要吸收的能量为946kJ、436kJ、391kJ.则1molN2完全反应转化为NH3共
查看习题详情和答案>>

(1)①②③④⑤五种元素中,金属性最强的元素是
钠
钠
(写元素名称),该元素的单质在空气中燃烧的化学方程式为2Na+O2
Na2O2
| ||
2Na+O2
Na2O2
.
| ||
(2)元素②的最高价氧化物对应的水化物的电子式为


>
>
③(填“>”或“<”)(3)画出元素④的原子结构示意图


HNO3
HNO3
.(4)写出元素⑤在周期表中的位置
第三周期ⅦA 族
第三周期ⅦA 族
,以海水中含量最大的物质为原料可以生产⑤的单质,同时还可以得到另外两种重的工业原料,该反应的化学方程式为2NaCl+2H2O
Cl2↑+H2↑+2NaOH
| ||
2NaCl+2H2O
Cl2↑+H2↑+2NaOH
.
| ||
(5)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外L层电子数是M层电子数的4倍.
①甲、乙元素分别为
铝
铝
、镁
镁
写元素名称)②写出②的最高价氧化物对应的水化物与甲的最高价氧化物反应的离子方程式
2NaOH+Al2O3=2NaAlO2+H2O
2NaOH+Al2O3=2NaAlO2+H2O
(6)已知破坏1mol N≡N键、H-H键、N-H键分别需要吸收的能量为946kJ、436kJ、391kJ.则1molN2完全反应转化为NH3共
放出
放出
(填“吸收”或“放出”)能量92
92
kJ.
(1)在上面元素周期表中全部是金属元素的区域为
b
b
(a)A (b)B (c)C (d)D
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或浓硝酸中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等.
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置.
②甲、乙两元素相比较,金属性较强的是
Mg
Mg
(填名称),可以验证该结论的实验是
bc
bc
.(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
③写出甲的氧化物及氧化物对应水化物分别与强碱反应的离子方程式
Al2O3 +2OH-═2AlO2-+H2O
Al2O3 +2OH-═2AlO2-+H2O
、Al(OH)3 +OH-═AlO2-+2H2O
Al(OH)3 +OH-═AlO2-+2H2O
.(3)表中所列小写字母分别代表一种化学元素:
①m、f、j的单质熔点由高到低的顺序
C>Si>P
C>Si>P
(填元素符号).②以上元素形成的金属单质中,熔点最低的是
Na
Na
(填元素符号).③f、m、n、g所形成的氢化物的稳定性还性由强到弱的顺序为
HCl、H2S、PH3、SiH4
HCl、H2S、PH3、SiH4
(填化学式);④甲、乙、c、d、e形成的简单离子的半径由小到大的顺序为
Al3+、Mg2+、Na+、O2-、N3-
Al3+、Mg2+、Na+、O2-、N3-
.⑤f元素单质是在生产中用量很大,试写出工业上制备f元素单质的化学方程式
SiO2+2C
2CO+Si
| ||
SiO2+2C
2CO+Si
.
| ||
⑥c元素的单质用途
氮气是合成氨、制硝酸的重要原料;由于其性质稳定常被用作保护气;在高科技领域中常用液氮制造低温环境
氮气是合成氨、制硝酸的重要原料;由于其性质稳定常被用作保护气;在高科技领域中常用液氮制造低温环境
(填一条).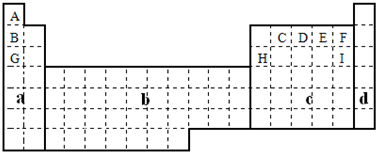
(1)在上面元素周期表中全部是金属元素的区域为
b
b
.(A)a(B)b(C)c(D)d
(2)G元素与 E元素形成的化合物的化学式是
Na2O
Na2O
、Na2O2
Na2O2
,它们都是离子化合物
离子化合物
(填“共价化合物”或“离子化合物”).表格中十种元素的最高价氧化物对应的水化物中,碱性最强的是KOH
KOH
(用化合物的化学式表示,下同),酸性最强的是HClO4
HClO4
,属于两性氢氧化物的是Al(OH)3
Al(OH)3
.(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等.
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置.
②甲、乙两元素相比较,金属性较强的是
镁
镁
(填名称),可以验证该结论的实验是bc
bc
.(填编号)(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性.

(1)在上面元素周期表中全部是金属元素的区域为
(b)
(b)
.(a)A (b)B (c)C (d)D
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或浓硝酸中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等.
用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置.
(3)表中所列小写字母分别代表一种化学元素:①f、m、n、g所形成的氢化物的稳定性还原性由强到弱的顺序为
HCl>H2S>PH3>SiH4
HCl>H2S>PH3>SiH4
(填化学式);②甲、乙、c、d、e形成的简单离子的半径由小到大的顺序为
Al3+、Mg2+、Na+、O2-、N3-
Al3+、Mg2+、Na+、O2-、N3-
.(离子用实际离子符号表示)③f的最高价氧化物制备对应的水化物的化学方程式
SiO2+2NaOH=Na2SiO3+H2O;Na2SiO3+2HCl═2NaCl+H2SiO3↓;
SiO2+2NaOH=Na2SiO3+H2O;Na2SiO3+2HCl═2NaCl+H2SiO3↓;
④c元素的单质用途
氮气是一种重要的工业原料,化学性质稳定,可做保护气
氮气是一种重要的工业原料,化学性质稳定,可做保护气
(填一条).