摘要:7.(江苏省丹阳高级中学2010届高三上学期期中考试A.B.C.D是中学常见的纯净物.它们之间的转化关系如图所示: (1).若A是由短周期中原子半径最大的元素构成的单质,D由短周期元素组成.既可溶于NaOH溶液又可溶于盐酸,则D的化学式为 . (2).若A常温下为红棕色气体.B是含氧酸盐.D不溶于盐酸.则D的化学式为 ,将等物质的量的C与A通入NaOH溶液无气体剩余.写出该反应的离子方程式: . (3).若C是元素M的气态氢化物.且C能与M的最高价氧化物的水化物反应生成盐E,B是一种正盐.与E含有相同的阳离子,D不溶于稀硝酸.A与B反应的离子方程式是 . 3 (2)H2SiO3(或H4SiO4) NO+NO2+2OH - =2NO2- + H2O (3)Ba2++2OH-+2NH4++SO42-=BaSO4↓+2NH3↑+2H2O
网址:http://m.1010jiajiao.com/timu3_id_414383[举报]
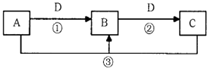 A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空:
A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空:(1)若D是生产、生活中用量最大、用途最广的金属单质
①若A可用于自来水消毒,则用A制备漂白粉的化学方程式是
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
.则C的化学式是FeCl2
FeCl2
.配制C的溶液时可加入少量的盐酸
盐酸
(填物质名称)以抑制水解.②若A是某强酸的稀溶液,则A的化学式可能是
HNO3
HNO3
.(2)若A是一种能使湿润的红色石蕊试纸变蓝的气体,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
(3)若B有两性
①若D是强酸,则能确定A、C中肯定含的离子的化学式分别是
AlO2-
AlO2-
、Al3+
Al3+
.②若D是强碱,则反应②的离子方程式是
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
.(4)若A、B、C的焰色反应都呈黄色,D是气态酸性氧化物,则D可能是
CO2
CO2
或SO2
SO2
(填化学式),鉴别它们常可选用品红溶液
品红溶液
、溴水或高锰酸钾溶液
溴水或高锰酸钾溶液
(任填两种试剂名称).(1)下列A、B、C、D是中学常见的混合物分离或提纯的基本装置.
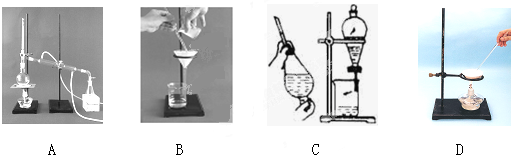
根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置(将A、B、C、D填入适当的空格中).
①除去Ca(OH)2溶液中悬浮的CaCO3
②从碘水中提取碘
③用自来水制取蒸馏水
④分离植物油和水
⑤除去食盐水中的泥沙
⑥与海水晒盐原理相符的是
(2)由可溶性铝盐制取氢氧化铝,需加入的试剂为:
白色的Fe(OH)2在空气中发生的颜色变化为
查看习题详情和答案>>

根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置(将A、B、C、D填入适当的空格中).
①除去Ca(OH)2溶液中悬浮的CaCO3
B
B
;②从碘水中提取碘
C
C
;③用自来水制取蒸馏水
A
A
;④分离植物油和水
C
C
;⑤除去食盐水中的泥沙
B
B
;⑥与海水晒盐原理相符的是
D
D
.(2)由可溶性铝盐制取氢氧化铝,需加入的试剂为:
氨水(或稀氨水)
氨水(或稀氨水)
;离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
.白色的Fe(OH)2在空气中发生的颜色变化为
白色迅速变为灰绿色最终变为红褐色
白色迅速变为灰绿色最终变为红褐色
.反应的化学方程式为:4Fe(OH)2+2H2O+O2═4Fe(OH)3
4Fe(OH)2+2H2O+O2═4Fe(OH)3
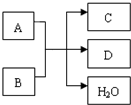
. 已知A、B、C、D是中学化学中常见的四种不同微粒,它们之间存在如图所示的转化关系.
已知A、B、C、D是中学化学中常见的四种不同微粒,它们之间存在如图所示的转化关系.(1)如果A、B是10电子离子,C、D是10电子分子,A、B、C、D均含有两种元素.请写出A、B的电子式:A




NH3
NH3
、DH2O
H2O
.(2)写出A离子与B反应的离子方程式:
OH-+NH4+=NH3↑+H2O
OH-+NH4+=NH3↑+H2O
. A、B、C、D是中学化学常见的物质,它们之间存在如图所示的转化关系.请按要求填空:
A、B、C、D是中学化学常见的物质,它们之间存在如图所示的转化关系.请按要求填空:(1)若A是贝壳的主要成分之一,B是厨房常见某调味品的一种成分,C常用于制作饮料,写出A与B反应的离子方程式:
(2)若A为黑色固体单质,C、D均能使澄清石灰水变浑浊,则A与B反应的化学方程式为
(3)若A为黑色粉末,C是能使石蕊试液褪色的气体,则A与B反应时还原剂与氧化剂的物质的量之比为
(4)若A为紫红色金属单质,C为无色气体,遇空气迅速变成红棕色,则产生1mol C时被氧化的A的物质的量为
(5)若A为无色晶体,易分解,分解产物之一遇C产生大量白烟,则检验A中阳离子的方法是
A、B、C、D是中学化学常见的四种短周期元素,已知:
①A元素原子最外层电子数是次外层电子数的2倍,且A与D同主族;
②B元素最高正价与负价的代数和为2;
③C元素有多种化合价,且常温下C元素的气态单质与NaOH溶液反应,可得两种含C元素的化合物;
④B、C两种元素质子数之和是A元素质子数的4倍.
(1)A、B、C三种元素最高价氧化物对应水化物的酸(碱)性由强到弱的顺序是(用化学式表示)
(2)B的最高价氧化物的水化物的稀溶液与铜单质反应,离子方程为
(3)B、D两元素可形成一种新型无机非金属化合物材料X.X可由C、D两元素形成的化合物Z与B的氢化物在一定条件下制得,则生成X的化学方程为
(4)由B、C两种元素组成的化合物Y,常温下为易挥发的淡黄色液体,Y分子为三角锥形分子,且B、C两种原子最外层均达到8个电子的稳定结构.Y遇水蒸气可生成一种常见的漂白性物质.则Y的电子式为
 ,Y与水反应产物的化学式为
,Y与水反应产物的化学式为
查看习题详情和答案>>
①A元素原子最外层电子数是次外层电子数的2倍,且A与D同主族;
②B元素最高正价与负价的代数和为2;
③C元素有多种化合价,且常温下C元素的气态单质与NaOH溶液反应,可得两种含C元素的化合物;
④B、C两种元素质子数之和是A元素质子数的4倍.
(1)A、B、C三种元素最高价氧化物对应水化物的酸(碱)性由强到弱的顺序是(用化学式表示)
HClO4>HNO3>H2CO3
HClO4>HNO3>H2CO3
,D元素在元素周期表中的位置是第三周期ⅣA族
第三周期ⅣA族
(2)B的最高价氧化物的水化物的稀溶液与铜单质反应,离子方程为
3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
,现有19.2g 铜粉溶解,产生标准状况下气体的体积是4.48
4.48
L.(3)B、D两元素可形成一种新型无机非金属化合物材料X.X可由C、D两元素形成的化合物Z与B的氢化物在一定条件下制得,则生成X的化学方程为
3SiCl4+4NH3═Si3N4+12HCl
3SiCl4+4NH3═Si3N4+12HCl
.(4)由B、C两种元素组成的化合物Y,常温下为易挥发的淡黄色液体,Y分子为三角锥形分子,且B、C两种原子最外层均达到8个电子的稳定结构.Y遇水蒸气可生成一种常见的漂白性物质.则Y的电子式为


NH3和HClO
NH3和HClO
.