摘要:21.某工厂排出的废水中含有金属Ba2+.为了测定其浓度.作如下实验: ①称取K2Cr2O7固体0.1323g溶于适量的稀硫酸中.再向其中加入过量KI.反应后用Na2S2O3 溶液与之反应.当用去27.00mL时恰好完全反应. ②另取废水50.00mL.控制适当的酸度加入足量的K2Cr2O7溶液.得BaCrO4沉淀.沉淀 经洗涤.过滤后.用适量的稀盐酸溶解.此时 CrO42- 转化为 Cr2O72-.再加过量KI 反应.反应液再同上述Na2S2O3 溶液反应.反应完全时.消耗Na2S2O3 溶液24.00mL. 已知有关的离子方程式为: Cr2O72-+ I-+ H+= Cr3++ I2+ I2+2S2O32-=2I-+S4O62- (1)配平上述方程式. (2)Na2S2O3 溶液的浓度为 . (3)求废水中Ba2+的物质的量浓度是多少? 贵州省兴义九中09-10学年高三上学期期中考试
网址:http://m.1010jiajiao.com/timu3_id_414089[举报]
某工厂排出的废水中含有大量的Fe2+、Cu2+和SO42-.为了减少污染,变废为宝,工程师们设计了如下流程,以回收铜和硫酸亚铁.请回答:

(1)原料①为
(2)写出加入原料②后反应的离子方程式:
(3)若在实验室中完成该流程,操作②需要用到的玻璃仪器的名称是

查看习题详情和答案>>

(1)原料①为
Fe
Fe
(填化学式).(2)写出加入原料②后反应的离子方程式:
Fe+2H+═Fe2++H2↑
Fe+2H+═Fe2++H2↑
.(3)若在实验室中完成该流程,操作②需要用到的玻璃仪器的名称是
玻璃棒
玻璃棒
、漏斗
漏斗
、烧杯
烧杯
;整个实验操作过程中不可能用到的装置是bd
bd
(填字母).
某工厂排出的废水中含有大量的Fe2+、Cu2+和SO42-.某校研究性学习小组设计如图流程以回收铜和硫酸亚铁.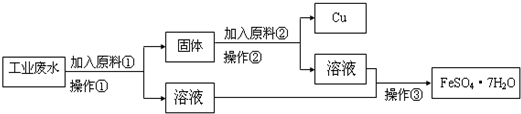
请回答:
(1)反应①的离子方程式为
(2)操作①中用到的玻璃仪器是
a.烧杯b.漏斗c.玻璃棒d.酒精灯
(3)原料②的名称为
(4)将氢氧化钠溶液滴加到硫酸亚铁溶液中,观察到的现象为
查看习题详情和答案>>

请回答:
(1)反应①的离子方程式为
Cu2++Fe═Cu+Fe2+
Cu2++Fe═Cu+Fe2+
.(2)操作①中用到的玻璃仪器是
abc
abc
(填序号).a.烧杯b.漏斗c.玻璃棒d.酒精灯
(3)原料②的名称为
稀硫酸
稀硫酸
.(4)将氢氧化钠溶液滴加到硫酸亚铁溶液中,观察到的现象为
先生成白色沉淀,后迅速变成灰绿色最终变成红褐色
先生成白色沉淀,后迅速变成灰绿色最终变成红褐色
有关反应的化学方程式为Fe2++2OH-═Fe(OH)2、4Fe(OH)2+O2+2H2O═4Fe(OH)3
Fe2++2OH-═Fe(OH)2、4Fe(OH)2+O2+2H2O═4Fe(OH)3
.
某工厂排出的废水中含有Ag+、Fe3+、Al3+三种金属离子。某同学设计了如下流程从废水中提取三种金属(流程中部分物质没有标出)。
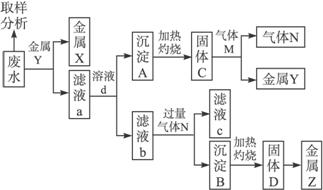
回答下列问题:
(1)固体C的化学式为____________,滤液b中通入过量气体N发生反应的离子方程式为____________________________________,固体D转化为金属Z的化学方程式为________________________。
(2)取样分析废水中Ag+、Fe3+、Al3+的含量,目的是____________。
a.控制溶液中Ag+、Fe3+、Al3+含量比 b.确定下一步加入金属Y的量
c.确定滤液a中加入溶液d的量 d.确定沉淀A转化为固体C所需的温度
查看习题详情和答案>> 。为了减少污染并变废为宝,工程师们设计了如下流程,以回收铜和硫酸亚铁。
。为了减少污染并变废为宝,工程师们设计了如下流程,以回收铜和硫酸亚铁。

 。为了减少污染并变废为宝,工程师们设计了如下流程,以回收铜和硫酸亚铁。
。为了减少污染并变废为宝,工程师们设计了如下流程,以回收铜和硫酸亚铁。
