摘要:59.答案:(1)FeS2 (2) (3)a b d (4)SO3(g) + H2O(l) = H2SO4(l),ΔH=-130.3kJ/mol (5)①SO2 + Br2 + 2H2O = 4H+ + 2Br- + SO42- ②14.56 2.31g 解析:本题主要考查硫酸工业.热化学方程式的书写.计算等. (1)根据原子守恒即可判断该物质为FeS2. (2)SO2和O2在接触室发生反应生成SO3:2SO2 + O2 2SO3. (3)选项a.将黄铁矿粉碎更增加反应接触面积而加快反应速率.选项b.增加空气(O2)浓度能提高SO2的转化率.选项c.催化剂对转化率无影响.选项d.矿渣中含有Fe2O3.可用于冶炼铁. (4)160g SO3(g)与H2O(l)反应生成H2SO4(l)放出260.6kJ热量.则1mol SO3(g)与H2O(l)反应生成H2SO4(l)放出130.3kJ热量.则相关热化学方程式为: SO3(g) + H2O(l)=H2SO4(l),△H=-130.3kJ/mol. (5)10g时说明铵盐不足,20g时说明氢氧化钠不足,由10.00g和20.00g 时浓硫酸增加的质量相同说明铵盐有酸式根产生的氨气, 氢氧化钠的物质的量浓度为Cmol/L 设10克中有Xmol的 (NH4)2SO4 和ymol的NH4HSO4则 132X + 115y=10--------------------.(1) 10g时说明铵盐不足由N守恒知 n(NH3)=2X + y 20g时铵盐已经过量.氢氧化钠先和酸式根反应.则(NH4)2SO4为2Xmol.2ymol的NH4HSO4 HSO4- + OH- = SO42- + H2O 1 1 2y 2y NH4+ + OH- = NH3 + H2O 1 1 50C×10-3-2y 50C×10-3-2y 由于产生的氨气一样多 n(NH3)=2X + y=50C×10-3-2y-------------.(2) 30g时铵盐过量.则(NH4)2SO4为3Xmol.3ymol的NH4HSO4 n(NH3)=0.68/17=0.04mol HSO4- + OH- = SO42- + H2O 1 1 3y 3y NH4+ + OH- = NH3 + H2O 1 1 50C×10-3-3y 0.04 所以 50C×10-3-3y=0.04--------------------.(3) 联立解得 X=0.02mol y=0.064mol C=4.64mol/L 氮的质量百分含量= ×100%= ×14/10×100%=14.56% 15g时铵盐已经过量.则(NH4)2SO4为1.5Xmol.1.5 ymol的NH4HSO4 HSO4- + OH- = SO42- + H2O 1 1 1.5y 1.5y NH4+ + OH- = NH3 + H2O 1 1 50C×10-3-1.5y 50C×10-3-1.5y n(NH3)= 50C×10-3-1.5y=50×4.64×10-3-1.5×0.064=0.136mol m(NH3)=0.136×17=2.31g
网址:http://m.1010jiajiao.com/timu3_id_413922[举报]
I.(1)如果SO2的漂白性是因为SO2与H2O反应的产物的漂白作用,那么SO2使品红溶液褪色的粒子可能是 .有一Na2SO3固体因部分被氧化而变质.为测定样品纯度,某同学设计了如下实验方案:称取m g样品溶于水,配成250mL溶液,用滴定管取V1 mL于锥形瓶中,用浓度为c mol?L-1 的标准酸性高锰酸钾溶液滴定至终点.反应关系为SO32-+MnO4_→SO42-+Mn2++H2O (未配平)
(2)配制样品溶液时,不一定需要的实验仪器是 (选填答案编号)
A、容量瓶B、玻璃棒 C、滴定管
(3)滴定管在注入酸性高锰酸钾溶液之前,先用蒸馏水洗净,再用 .
(4)滴定终点的现象是 .
(5)滴定至终点消耗高锰酸钾溶液的体积为V2 mL,则原样品中Na2SO4的质量分数为
Ⅱ.FeCO3是白色沉淀,已知Ksp(FeCO3)=2×10-11,将FeCl2稀溶液与Na2CO3溶液等体积混合,若原FeCl2溶液的浓度为2×10-5 mol/L,则生成沉淀所需Na2CO3溶液最小浓度为 mol/L.
查看习题详情和答案>>
(2)配制样品溶液时,不一定需要的实验仪器是
A、容量瓶B、玻璃棒 C、滴定管
(3)滴定管在注入酸性高锰酸钾溶液之前,先用蒸馏水洗净,再用
(4)滴定终点的现象是
(5)滴定至终点消耗高锰酸钾溶液的体积为V2 mL,则原样品中Na2SO4的质量分数为
Ⅱ.FeCO3是白色沉淀,已知Ksp(FeCO3)=2×10-11,将FeCl2稀溶液与Na2CO3溶液等体积混合,若原FeCl2溶液的浓度为2×10-5 mol/L,则生成沉淀所需Na2CO3溶液最小浓度为
常温下,有甲、乙两份体积均为1L,pH均为3的溶液,其中甲为醋酸,乙为盐酸.
①甲用蒸馏水稀释至100倍后,溶液的pH变为a;
②乙与等体积、浓度为1.5mol/L的氨水混合,在此混合液中:n(NH
)+n(H+)-n(OH-)=b mol.
则a、b正确的答案组合是( )
①甲用蒸馏水稀释至100倍后,溶液的pH变为a;
②乙与等体积、浓度为1.5mol/L的氨水混合,在此混合液中:n(NH
+ 4 |
则a、b正确的答案组合是( )
查看习题详情和答案>>
常温下,有甲、乙两份体积均为lL,浓度均为0.1mol/L的氨水,其pH为11.①甲用蒸馏水稀释100倍后,溶液的pH将为a;②乙与等体积、浓度为0.2mol/L的盐酸混合,在混合溶液中:n(NH4+)+n(H+)-n(OH-)=bmol.则a、b正确的答案组合是( )
查看习题详情和答案>>
全世界每年被腐蚀损耗的钢铁量非常惊人,在潮湿空气中发生吸氧腐蚀是钢铁腐蚀的主要原因。
(1)在潮湿空气中,钢铁发生吸氧腐蚀时的负极反应的电极反应式为_____________。
(2)已知草酸(H2C2O4)分解的化学方程式为:H2C2O4  CO↑ + CO2↑ + H2O,
CO↑ + CO2↑ + H2O,
下列装置中,可用作草酸分解制取气体的是______(填答案编号)。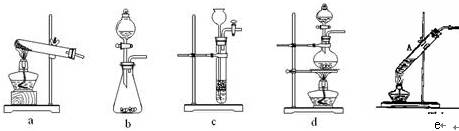
(3)某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3·nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。
①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的液态试剂依次可能是_______、
________(填答案编号)。
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液 d.无水氯化钙
②在点燃C处酒精灯之前应进行的操作是:(a)检查装置气密性;(b)____________。
③E装置的作用是______________________________________________________,
上述装置最后尾气处理的方法是_____________。
④准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32 g,D中浓硫酸增重0.72 g,则n =_____________。
⑤在本实验中,下列情况会使测定结果n偏大的是__________(填答案编号)。
a.缺少装置B b.缺少装置E c.反应后的固体中有少量Fe2O3·nH2O