摘要:53.答案:(1)H2O.H+.SO42-中的某一种粒子能够使CuO溶解 (2)水不能使氧化铜溶解.而是另外的H+.SO42-两种粒子中的一种粒子使CuO溶解 (3)Na2SO4(或K2SO4等).稀硫酸 (4)氧化铜固体溶于稀H2SO4是稀硫酸H+在起作用.而H2O.SO42-两种粒子都不能使CuO溶解 (5)硝酸或盐酸等 解析:(3)在Ⅱ中加入稀硫酸后氧化铜溶解.还不能确定是H+或SO42-中的某一种粒子能够使CuO溶解.可再加入SO42-验证.
网址:http://m.1010jiajiao.com/timu3_id_413916[举报]
(10分)氧化铜是一种黑色固体,可溶于稀硫酸。某同学想知道是稀硫酸的哪种粒子(H2O,H+,SO![]() )能使氧化铜溶解。请你和他一起通过如图Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。
)能使氧化铜溶解。请你和他一起通过如图Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。
①你提出的假设是 ;
②通过实验Ⅰ可以证明 ;
③要证明另外两种粒子能否溶解氧化铜,
还需要进行实验Ⅱ和Ⅲ,在Ⅲ中应加入 ;
④探究结果为 。你认为除实验Ⅱ和Ⅲ所用的试剂外,还能溶解氧化铜的一种常见物质是 。
查看习题详情和答案>>(2013?德州一模)氮及其化合物在工农业生产、生活中有者重要作用.请回答下列问题:

(1)图1是1molNO2和1mol CO反应生成CO2和NO过程中能星变化示意图(a、b均大 于0>,且知:
2CO(g)+2NO(g)=N2(g)+2CO2(g)△H=-ckJ?mol-1(c>0)
请写出CO将NO2还原至N2时的热化学方程式
(2)图2是实验室在三个不同条件的密闭容器中合成氨时,N2的浓度随时间的变化曲线(以a、b、c表示).已知三个条件下起始加入浓度均为:c(N2)=0.1mol?L-1,c(H2)=0.3mol?L-1;合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H<0
①计算在a达平衡时H2的转化率为
②由图2可知,b、c各有一个条件与a不同,则c的条件改变可能是
(3)利用图2中c条件下合成氨(容积固定).已知化学平衡常数K与温度(T)的关系如 下表:
①试确定K1的相对大小,K1
②下列各项能作为判断该反应达到化学平衡状态的依据的是
A.容器内NH3的浓度保持不变 B.2v( N2)(正)-v( H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)①NH4Cl溶液呈酸性的原因是(用离子反应方程式表示)
②25°C时,将PH=x氨水与pH=y的疏酸(且x+y-14,x>11 )等体积混合后,所得溶液 中各种离子的浓度关系正确的是
A.[SO
]>[NH
]>[H+]>[OH-]
B.[NH
]>[SO
]>[OH-]>[H+]
C.[NH
]+[H+]>[SO
]+[OH-]
D.[NH
]>[SO
]>[H+]>[OH-].
查看习题详情和答案>>

(1)图1是1molNO2和1mol CO反应生成CO2和NO过程中能星变化示意图(a、b均大 于0>,且知:
2CO(g)+2NO(g)=N2(g)+2CO2(g)△H=-ckJ?mol-1(c>0)
请写出CO将NO2还原至N2时的热化学方程式
4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=-(2b+c-2a)KJ/mol
4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=-(2b+c-2a)KJ/mol
;(2)图2是实验室在三个不同条件的密闭容器中合成氨时,N2的浓度随时间的变化曲线(以a、b、c表示).已知三个条件下起始加入浓度均为:c(N2)=0.1mol?L-1,c(H2)=0.3mol?L-1;合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H<0
①计算在a达平衡时H2的转化率为
40%
40%
;②由图2可知,b、c各有一个条件与a不同,则c的条件改变可能是
升高温度
升高温度
;试写出判断b与a条件不同的理由因为加入催化剂能缩短达到平衡的时间,但化学平衡不移动,所以ba条件下达到平衡状态氮气的浓度相同
因为加入催化剂能缩短达到平衡的时间,但化学平衡不移动,所以ba条件下达到平衡状态氮气的浓度相同
;(3)利用图2中c条件下合成氨(容积固定).已知化学平衡常数K与温度(T)的关系如 下表:
| T/(K) | 298 | 398 | 498 | … |
| K/(mol?L-1)-2 | 4.1×106 | K1 | K2 | … |
<
<
4.1x106(填写“>”“-”或“<”)②下列各项能作为判断该反应达到化学平衡状态的依据的是
AC
AC
(填序号字母).A.容器内NH3的浓度保持不变 B.2v( N2)(正)-v( H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)①NH4Cl溶液呈酸性的原因是(用离子反应方程式表示)
NH4++H2O?NH3?H2O+H+
NH4++H2O?NH3?H2O+H+
.②25°C时,将PH=x氨水与pH=y的疏酸(且x+y-14,x>11 )等体积混合后,所得溶液 中各种离子的浓度关系正确的是
A.[SO
2- 4 |
+ 4 |
B.[NH
+ 4 |
2- 4 |
C.[NH
+ 4 |
2- 4 |
D.[NH
+ 4 |
2- 4 |
(1)补充完成下表:(请把序号①一⑦的答案填在相应的位置上)
(2)甲元素最高价氧化物对应的水化物呈
(3)甲与乙两元素的单质反应生成物的电子式为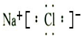
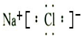 .
.
(4)乙单质与丙的氢化物反应的离子方程式为
查看习题详情和答案>>
| 元素 | 甲 | 乙 | 丙 |
| 元素符号 | ① Na Na |
② Cl Cl |
O |
| 原子结构示意图 | 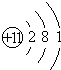 |
③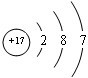  |
④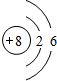 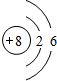 |
| 周期 | 三 | 三 | ⑤ 二 二 |
| 族 | ⑥ IA IA |
ⅦA | ⑦ VIA VIA |
碱
碱
性(填“酸、碱”),乙元素对应的水化物的化学式为HClO4
HClO4
.(3)甲与乙两元素的单质反应生成物的电子式为
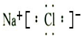
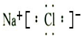
(4)乙单质与丙的氢化物反应的离子方程式为
Cl2+H2O?HClO+H++Cl-
Cl2+H2O?HClO+H++Cl-
.氧化铜是一种黑色固体,可溶于稀硫酸。某同学想知道是稀硫酸的哪种粒子(H2O、H+、SO)能使氧化铜溶解。请你和他一起通过如图所示的Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。
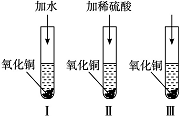
(1)某同学提出的假设是____________________________________________________。
(2)通过实验Ⅰ可以证明___________________________________________________。
(3)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步确认的实验操作是:在Ⅲ中先加入________,再加入________。
(4)探究结果为______________________。你认为除实验Ⅱ和Ⅲ所用的试剂外,还能溶解氧化铜的一种常见物质是________。
查看习题详情和答案>> )+ c(OH–)
)+ c(OH–)