摘要:48.答案:(1)SO2 +2OH-=SO32-+H2O (2)红色褪去 溶液又恢复红色 氧化 (3)吸收有害气体.防止污染空气 NaHCO3+SO2=NaHSO3+CO2 (或2NaHCO3+SO2=Na2SO3+2CO2↑+H2O) 解析:Cu丝与浓H2SO4在加热条件下生成SO2气体.通入品红溶液.SO2有漂白性.使品红溶液褪色.加热恢复红色,过量的SO2气体.通入H2S溶液中.发生反应:2H2S+SO22H2O+3S↓.SO2是氧化剂.为防止过量的SO2逸出污染空气.用NaOH溶液吸收.如用NaHCO3溶液代替NaOH也可以.因NaHCO3溶液能与SO2反应.
网址:http://m.1010jiajiao.com/timu3_id_413911[举报]
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行有关实验.请回答:

(1)装置A中发生的化学反应方程式为
(2)装置D中试管口放置的棉花中应浸一种液体,这种液体是
(3)装置B的作用是贮存多余的气体.当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是
a.水 b.酸性KMnO4 溶液 c.NaOH溶液 d.饱和NaHSO3溶液
(4)装置C和D中产生的现象相同,但原因却不同.C中是由于SO2
(5)实验中,取一定质量的铜片和50mL18mol?L-1的浓硫酸放在圆底烧瓶中加热,直到反应完毕生成SO2共0.25mol,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①假设溶液体积还是50mL,则剩余硫酸的物质的量浓度为
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是
a.铁粉 b.BaCl2溶液 c.银粉 d.Na2CO3溶液.
查看习题详情和答案>>

(1)装置A中发生的化学反应方程式为
Cu+2H2SO4(浓)
Cu(SO4)2+SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
Cu(SO4)2+SO2↑+2H2O
.
| ||
(2)装置D中试管口放置的棉花中应浸一种液体,这种液体是
氢氧化钠溶液或碳酸钠溶液等碱性溶液
氢氧化钠溶液或碳酸钠溶液等碱性溶液
,其作用是吸收多余的二氧化硫,防止污染空气
吸收多余的二氧化硫,防止污染空气
.(3)装置B的作用是贮存多余的气体.当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是
瓶中液面下降,长颈漏斗中液面上升
瓶中液面下降,长颈漏斗中液面上升
,B中应放置的液体是(填字母)d
d
.a.水 b.酸性KMnO4 溶液 c.NaOH溶液 d.饱和NaHSO3溶液
(4)装置C和D中产生的现象相同,但原因却不同.C中是由于SO2
与氢氧化钠溶液反应使酚酞试液变为无色
与氢氧化钠溶液反应使酚酞试液变为无色
,反应的离子方程式为SO2+2OH-=SO32-+H2O
SO2+2OH-=SO32-+H2O
,而D中则是由于SO2具有具有漂白性使品红褪色
具有漂白性使品红褪色
.(5)实验中,取一定质量的铜片和50mL18mol?L-1的浓硫酸放在圆底烧瓶中加热,直到反应完毕生成SO2共0.25mol,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①假设溶液体积还是50mL,则剩余硫酸的物质的量浓度为
8
8
mol?L-1.②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是
ad
ad
(填字母).a.铁粉 b.BaCl2溶液 c.银粉 d.Na2CO3溶液.
黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取硫酸的主要原料.某化学学习小组对某黄铁矿石进行如下实验探究.[实验一]测定硫元素的含量.
Ⅰ、将m1g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.石英管中发生反应的化学方程式为:4FeS2+11O2
2Fe2O3+8SO2.
Ⅱ、反应结束后,将乙瓶中的溶液进行如图2所示处理.
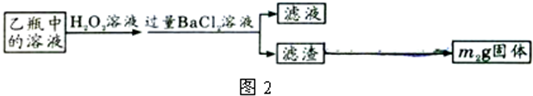
[实验二]测定铁元素的含量.
Ⅲ、测定铁元素含量的实验步骤如图3所示.

问题讨论:
(1)Ⅰ中,甲瓶内所盛试剂是
(2)Ⅱ中的滤渣在称量前还应进行的操作是
(3)Ⅱ中,所加H2O2溶液(氧化剂)需足量的理由是
(4)④中取稀释液25.00ml需用的仪器是
(5)该黄铁矿中硫元素的质量分数为
×100%
×100%.
查看习题详情和答案>>
Ⅰ、将m1g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.石英管中发生反应的化学方程式为:4FeS2+11O2
| ||

Ⅱ、反应结束后,将乙瓶中的溶液进行如图2所示处理.

[实验二]测定铁元素的含量.
Ⅲ、测定铁元素含量的实验步骤如图3所示.

问题讨论:
(1)Ⅰ中,甲瓶内所盛试剂是
NaOH
NaOH
溶液.乙瓶内发生反应的离子方程式有:SO2+2OH-=SO32-+H2O
SO2+2OH-=SO32-+H2O
、2SO32-+O2=2SO42-
2SO32-+O2=2SO42-
.(2)Ⅱ中的滤渣在称量前还应进行的操作是
洗涤、干燥
洗涤、干燥
.(3)Ⅱ中,所加H2O2溶液(氧化剂)需足量的理由是
使SO32-完全氧化为SO42-
使SO32-完全氧化为SO42-
.(4)④中取稀释液25.00ml需用的仪器是
酸式滴定管
酸式滴定管
.Ⅲ的步骤③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有250ml 容量瓶
250ml 容量瓶
(画出其简易装置图).(5)该黄铁矿中硫元素的质量分数为
| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |