摘要:13.答案:CD 解析:选项A 中SO3虽可与水反应生成硫酸.但工业生产硫酸是用98.3%的浓硫酸来吸收SO3而不使用水.选项B 中Cl2和SO2都有较好的漂白作用.但是二者混合后会发生Cl2+SO2+2H2O2HCl+H2SO4.若二者的体积比为1︰1.混合气体将失去漂白能力.
网址:http://m.1010jiajiao.com/timu3_id_413876[举报]
(NH4)2PtCl6晶体受热分解,生成氮气、氯化氢、氯化铵和金属铂,在此分解反应中,氧化产物与还原产物的物质的量之比是
A.2:3 B.3:2 C.4:3 D.1:3
【解析】根据反应前后的元素的化合价变化可判断,N元素由-3价升高到0,即氮气是氧化产物,每生成1mol氮气转移6mol电子。Pt的化合价由+4价降低到0价,所以Pt是还原产物。根据得失电子守恒可知生成铂的物质的量是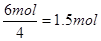 ,所以氧化产物和还原产物的物质的量之比是2:3,选项A正确。答案选A。
,所以氧化产物和还原产物的物质的量之比是2:3,选项A正确。答案选A。
查看习题详情和答案>>
构成下列四种物质的微粒间,既存在离子键又存在共价键的是( )
A.KOH B.K2S C.MgCl2 D.SO3
【解析】考查化学键的判断。一般情况下活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键,所以选项A、B、C、D中含有的化学键分别为离子键和极性键、离子键、离子键、极性键。因此答案是A。
查看习题详情和答案>>
与氢氧根离子具有相同的质子数和电子数的微粒是( )
A.CH4 B.NH4+ C.NH2- D.Cl-
【解析】OH-含有的质子数和电子数分别为9和10,选项A、B、C、D中含有的质子数和电子数分别为10和10、11和10、9和10、17和18。所以答案是C。
查看习题详情和答案>>
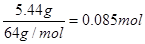 ,则反应后生成的硝酸铜也是0.085mol,即没有被还原的硝酸是0.085mol×2=0.17mol。硝酸的还原产物是NO和NO2的混合物,因此被还原的硝酸是
,则反应后生成的硝酸铜也是0.085mol,即没有被还原的硝酸是0.085mol×2=0.17mol。硝酸的还原产物是NO和NO2的混合物,因此被还原的硝酸是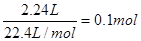 ,所以原硝酸的物质的量至少是0.27mol,其浓度至少为
,所以原硝酸的物质的量至少是0.27mol,其浓度至少为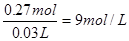 。即选项A是正确的。答案是A。
。即选项A是正确的。答案是A。