摘要:2.请将第Ⅰ卷的正确选项用2B铅笔涂在答题卡上.考试结束只收答题卡和第Ⅱ卷. 可能用到的相对原子质量 H:1 C:12 N:14 O:16 第Ⅰ卷 选择题(本题15包括小题.每小题3分.共45分.每小题只有一个选项符合题意.)
网址:http://m.1010jiajiao.com/timu3_id_413668[举报]
氨气在工农业生产中有重要的用途.某校甲、乙两个化学小组分别对氨的相关实验进行了研究.
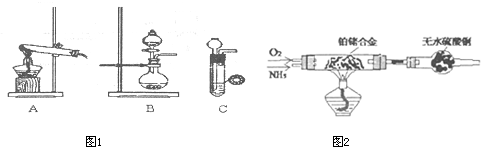
(1)甲、乙两小组选择了不同方法制(图1)取氨气,请将实验装置的字母编号和制备原理填写在下表空
格中.
(2)甲组通过图2装置(尾气处理装置已略去)验证了氨有还原性,装置中的实验现象是 ,硬质玻璃管中氨发生催化氧化反应的化学方程式为 .
(3)甲组将足量氨气不断通入滴有酚酞的AgNO3溶液中,现象为 ,反应结束所得溶液中除了H+、OH-、NH4+外还主要含有的离子有 .
(4)乙组欲制备氮化镁,查阅资料发现氨跟氧化铜反应可以制备氮气(2NH3+3CuO
3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3.乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向).你认为此方案是否正确,并说明理由 .
 查看习题详情和答案>>
查看习题详情和答案>>

(1)甲、乙两小组选择了不同方法制(图1)取氨气,请将实验装置的字母编号和制备原理填写在下表空
格中.
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、氯化铵 | 反应的化学方程式为 ① |
| 乙小组 | ② |
浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③ |
(3)甲组将足量氨气不断通入滴有酚酞的AgNO3溶液中,现象为
(4)乙组欲制备氮化镁,查阅资料发现氨跟氧化铜反应可以制备氮气(2NH3+3CuO
| ||
 查看习题详情和答案>>
查看习题详情和答案>>
亚铁是血红蛋白的重要组成成分,起着向人体组织传送O2的作用,人如果缺铁就可能出现缺铁性贫血,但是摄入过量的铁也有害.下面是一种补铁药品说明书中的部分内容:该药品为无水碱式盐,含Fe2+34%~36%,是糖衣片,…,与Vc(维生素C)同服可增加本品吸收.某同学设计实验时对其中的铁成分进行了验证.请完成该实验:
(1)第一步:查阅资料得知,双氧水可以氧化SCN-生成N2、CO2和SO42-,也可以将Fe2+氧化成Fe3+.
(2)第二步:向去掉糖衣、研磨好的药品中加稀盐酸,出现淡绿色浑浊液,说明有 离子存在(填离子符号);
(3)第三步:往上述溶液中滴入几滴KSCN溶液,出现浅红色,说明溶液中有少量Fe3+离子存在.该离子存在的原因可能是(填序号):
①药品中的铁本来就是以三价铁的形式存在;
②在制药过程中生成少量三价铁;
③本实验过程中有少量三价铁生成.
(4)第四步:将第三步所得溶液分成2份,分别装在A、B两个试管中.
(5)第五步:向A试管的溶液中加入少量稀硫酸,再慢慢滴入过量的H2O2溶液,溶液的红色先变深,之后红色逐渐褪去.
①红色变深的原因是(用离子方程式表示): ;
②溶液红色又褪去的原因可能是: ;
③请自选中学实验室中常用仪器、药品,设计实验证明溶液红色褪去的原因: .
(6)第六步:向B试管的溶液中加入一片Vc片,片刻后溶液红色也褪去,说明Vc有 性;怎样理解药品说明中所述“与Vc同服可增加本品吸收”这句话? .
查看习题详情和答案>>
(1)第一步:查阅资料得知,双氧水可以氧化SCN-生成N2、CO2和SO42-,也可以将Fe2+氧化成Fe3+.
(2)第二步:向去掉糖衣、研磨好的药品中加稀盐酸,出现淡绿色浑浊液,说明有
(3)第三步:往上述溶液中滴入几滴KSCN溶液,出现浅红色,说明溶液中有少量Fe3+离子存在.该离子存在的原因可能是(填序号):
①药品中的铁本来就是以三价铁的形式存在;
②在制药过程中生成少量三价铁;
③本实验过程中有少量三价铁生成.
(4)第四步:将第三步所得溶液分成2份,分别装在A、B两个试管中.
(5)第五步:向A试管的溶液中加入少量稀硫酸,再慢慢滴入过量的H2O2溶液,溶液的红色先变深,之后红色逐渐褪去.
①红色变深的原因是(用离子方程式表示):
②溶液红色又褪去的原因可能是:
③请自选中学实验室中常用仪器、药品,设计实验证明溶液红色褪去的原因:
(6)第六步:向B试管的溶液中加入一片Vc片,片刻后溶液红色也褪去,说明Vc有
某校的研究性学习小组进行测定混合物各组分质量比的研究,甲、乙、丙三位同学各设计了一种实验方案如下表所示:(混合物的质量事先已称量好)
试回答下列问题:
①你认为甲同学设计的实验步骤中,根据称量所得到的数据,
②经讨论大家认为,乙同学所设计的实验步骤的第四步填写一定有错误.其理由是
③丙同学对实验进行了设计,请将其后三步正确的内容仿照前面的形式填入对应的空格内.
查看习题详情和答案>>
| 实验 序号 |
混合物 |
第一步: 加入适量水,充分溶解 |
第二步: 加入或通入的试剂 |
第三步: 过滤后洗涤干燥所得固体 |
第四步: 蒸发滤液得到晶体 |
第五步: 称量,记录数据 |
| 甲 | BaCl2 NaCl |
澄清溶液 | 过量CO2 | 无固体 | 晶体 | 称量所得晶体 |
| 乙 | CaCl2 NaCl |
澄清溶液 | 过量饱和Na2CO3溶液 | CaCO3 | NaCl | 称量蒸发所得晶体 |
| 丙 | Na2SO4 MgSO4 |
澄清溶液 | 过量NaOH溶液 |
①你认为甲同学设计的实验步骤中,根据称量所得到的数据,
不能
不能
(填“能”或“不能”)准确计算得出混合物中各组分的质量比.②经讨论大家认为,乙同学所设计的实验步骤的第四步填写一定有错误.其理由是
第二步加入的碳酸钠溶液为过量的,最后所得晶体中应有碳酸钠存在
第二步加入的碳酸钠溶液为过量的,最后所得晶体中应有碳酸钠存在
.③丙同学对实验进行了设计,请将其后三步正确的内容仿照前面的形式填入对应的空格内.
甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计了如下实验流程:
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶.
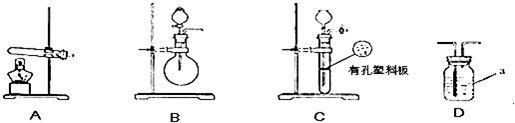
实验开始前装置中的空气已排尽.甲小组测得:反应前氧化铜的质量为m1g、氧化铜反应后剩余固体的质量为m2g、生成氮气在标准状况下的体积V1L.乙小组测得洗气装置D前后的质量和生成氮气在标准状况下的体积.
(1)写出仪器a的名称: .
(2)甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中.
(3)甲小组用所测数据计算出氨分子中氮、氢的原子个数之比为 .
(4)在操作和计算正确的情况下,乙小组用所测数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因可能是 .
(5)乙小组在原有实验的基础上增加了一个装有药品的实验仪器,重新实验,得出合理的实验结果.该药品的名称是 .
查看习题详情和答案>>

下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶.

实验开始前装置中的空气已排尽.甲小组测得:反应前氧化铜的质量为m1g、氧化铜反应后剩余固体的质量为m2g、生成氮气在标准状况下的体积V1L.乙小组测得洗气装置D前后的质量和生成氮气在标准状况下的体积.
(1)写出仪器a的名称:
(2)甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中.
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为 ① |
| 乙小组 | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③ |
(4)在操作和计算正确的情况下,乙小组用所测数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因可能是
(5)乙小组在原有实验的基础上增加了一个装有药品的实验仪器,重新实验,得出合理的实验结果.该药品的名称是
微粒A、B、C为分子,D和F为阳离子,E为阴离子,它们都含有l0个电子;B溶于A后所得的物质可电离出D和E;C是重要的化石能源.将A、B和含F离子的物质混合后可得D和一种白色沉淀.G3+离子与Ar原子的电子层结构相同.请回答:
(1)基态G原子的外围电子排布式是 .在A、B、C这三种分子中,属于非极性分子的有 (写化学式).
(2)下列有关B的说法中正确的是 .(填字母)
a.在配合物中可作为配体
b.该分子的稳定性与氢键有关
c.分子中各原子最外层均为8e-的稳定结构
d.含1molB的液体中有3mol氢键
(3)根据等电子体原理,D离子的空间构型是 ,其中心原子轨道的杂化类型是 .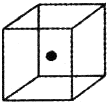
(4)构成C的中心原子可以形成多种单质,其中有一种为空间网状结构,如图立方体中心的“●”表示该晶体中的一个原子,请在该立方体的顶点上用“●”表示出与之紧邻的原子.
(5)光谱证实F与烧碱溶液反应有Na[F(OH)4]生成,则Na[F(OH)4]中不存在 .(填字母)
a.金属键 b.离子键 c.非极性键 d.极性键 f.配位键 g.σ键 h.π键.
查看习题详情和答案>>
(1)基态G原子的外围电子排布式是
(2)下列有关B的说法中正确的是
a.在配合物中可作为配体
b.该分子的稳定性与氢键有关
c.分子中各原子最外层均为8e-的稳定结构
d.含1molB的液体中有3mol氢键
(3)根据等电子体原理,D离子的空间构型是

(4)构成C的中心原子可以形成多种单质,其中有一种为空间网状结构,如图立方体中心的“●”表示该晶体中的一个原子,请在该立方体的顶点上用“●”表示出与之紧邻的原子.
(5)光谱证实F与烧碱溶液反应有Na[F(OH)4]生成,则Na[F(OH)4]中不存在
a.金属键 b.离子键 c.非极性键 d.极性键 f.配位键 g.σ键 h.π键.