摘要:20.某化学兴趣小组探讨Fe3+与SO32-之间的反应情况.请您参与并协助完成实验. (1)提出猜想:①发生氧化还原反应.请你配平反应的离子方程式 ②发生双水解反应.其反应的离子方程式 2Fe3++3SO32-+6H2OFe(OH)3+3H2SO3 (2)实验验证: ①检验Na2SO3溶液是否变质.取Na2SO3溶液.加入过量盐酸后.再加入BaCl2溶液.无沉淀产生.结论: 写出有关反应的离子方程式: ②取5mL FeCl3溶液于试管中.逐滴加入Na2SO3溶液至过量.观察到:溶液由黄色变为红棕色.无气体产生.也没有沉淀产生. ③将②溶液加入过量稀盐酸.分成两等份.一份加入BaCl2溶液.产生白色沉淀,另一份加入几滴KSCN溶液.溶液呈血红色. (3)得出结论:根据上述实验现象.得出Fe3+与SO32-之间发生反应的情况是: (4)拓展探究:实验小组的一位同学在FeCl3溶液中加入Na2CO3溶液.观察到有红褐色沉淀产生.并有无色气体放出. ①写出反应的离子方程式: ②SO32-的水解能力 CO32-
网址:http://m.1010jiajiao.com/timu3_id_413666[举报]
某化学兴趣小组用铁矿石(主要成分为Fe2O3,还有SiO2、Al2O3等杂质)提取Fe2O3.操作过程如下: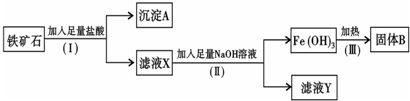
(1)(I)和(Ⅱ)步骤中分离溶液和沉淀的操作名称是
(2)沉淀A中主要含有
(3)滤液Y中的阴离子除OH-、Cl-外,还有
(4)写出(Ⅱ)步骤中生成Fe(OH)3的离子方程式
查看习题详情和答案>>

(1)(I)和(Ⅱ)步骤中分离溶液和沉淀的操作名称是
过滤
过滤
;(2)沉淀A中主要含有
SiO2
SiO2
(填化学式),固体B是Fe2O3
Fe2O3
(填化学式);(3)滤液Y中的阴离子除OH-、Cl-外,还有
AlO2-
AlO2-
(填化学式);(4)写出(Ⅱ)步骤中生成Fe(OH)3的离子方程式
Fe3++3OH-=Fe(OH)3↓
Fe3++3OH-=Fe(OH)3↓
.某化学兴趣小组用只含有铝、铁、铜的工业废料制取纯净的氯化铝溶液、绿矾晶体[FeSO4?7H2O]和胆矾晶体,以探索工业废料的再利用.其实验方案如下:
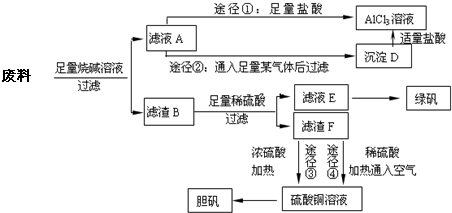
回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式
(2)由滤液A制AlCl3溶液的途径有①和②两种,途径②中通入的某气体其固态可用于人工降雨,则该气体是
(3)滤液E若放置在空气中一段时间后,溶液中的阳离子除了Fe2+和H+外,还最可能存在的阳离子是
(4)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是
(5)途径③发生的反应中,体现了浓硫酸
查看习题详情和答案>>

回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.(2)由滤液A制AlCl3溶液的途径有①和②两种,途径②中通入的某气体其固态可用于人工降雨,则该气体是
CO2
CO2
(填化学式),滤液A与过量的某气体生成沉淀D的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
.你认为较合理的途径是②
②
(填①或②),理由是途径①会引入盐酸,氯化钠杂质
途径①会引入盐酸,氯化钠杂质
.(3)滤液E若放置在空气中一段时间后,溶液中的阳离子除了Fe2+和H+外,还最可能存在的阳离子是
Fe3+
Fe3+
(用离子符号表示),检测该离子的方法是取滤液E少量于试管中,滴入2~3滴KSCN溶液,若出现血红色,则证明滤液E中含有Fe3+
取滤液E少量于试管中,滴入2~3滴KSCN溶液,若出现血红色,则证明滤液E中含有Fe3+
.(4)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是
产生等量胆矾途径④消耗硫酸少
产生等量胆矾途径④消耗硫酸少
、途径④不会产生污染大气的气体
途径④不会产生污染大气的气体
.(5)途径③发生的反应中,体现了浓硫酸
强氧化
强氧化
性和酸
酸
性.通过途径④制取胆矾,必须进行的实验操作步骤:加硫酸、加热通氧气、过滤、蒸发浓缩、冷却结晶、过滤
过滤
、自然干燥.其中途径④发生的反应为2Cu+O2+4H+=2Cu2++2H2O
2Cu+O2+4H+=2Cu2++2H2O
(用一个离子方程式表示).某化学兴趣小组测定某Fe2(SO4)3样品(只含少量Fec12杂质)中铁元素的质量分数,按以下实验步骤进行操作:
①称取ag样品,置于烧杯中;
②加入50mL 1.0mol/L稀硫酸和一定量的蒸馏水,使样品溶解,然后准确配制成250.00mL溶液;
③量取25.00mL步骤 ②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦…
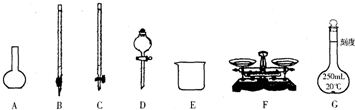
请根据上面叙述,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器有E和 (填字母).
(2)步骤②中:配制50mL,1.0mol/L稀H2SO4需要98%(密度1.84g/cm3)的浓H2SO4体积为 mL,量取该体积的浓H2SO4用到量筒规格是 .
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
Fe2++ ClO2+ ═ Fe3++ Cl-+ H2O
从理论上分析,上述实验中若将氯水改为ClO2时,对实验结果造成 (填偏大、偏小或不影响),等物质的量的ClO2与Cl2的氧化效率之比为 .
(4)第⑥步的操作中,将沉淀物转移到 (填仪器名称)中加热,冷却至室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,若m1与m2差值较大,接下来的操作应当是 .
(5)若步骤⑥不在干燥器中冷却,则测定的铁元素的质量分数会 (填偏大、偏小或不影响);若容器质量是W1g,最终容器和固体的总质量是W2g,则样品中铁元素的质量分数为 ,(列出算式,不需化简)
查看习题详情和答案>>
①称取ag样品,置于烧杯中;
②加入50mL 1.0mol/L稀硫酸和一定量的蒸馏水,使样品溶解,然后准确配制成250.00mL溶液;
③量取25.00mL步骤 ②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦…

请根据上面叙述,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器有E和
(2)步骤②中:配制50mL,1.0mol/L稀H2SO4需要98%(密度1.84g/cm3)的浓H2SO4体积为
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
从理论上分析,上述实验中若将氯水改为ClO2时,对实验结果造成
(4)第⑥步的操作中,将沉淀物转移到
(5)若步骤⑥不在干燥器中冷却,则测定的铁元素的质量分数会
民族中学某化学兴趣小组利用铁锈(Fe2O3)做了系列实验,物质间关系图如下.根据所学知识回答相关问题:
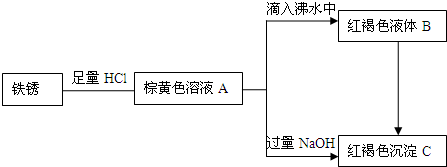
(1)写出A、B、C三种物质的名称:A
(2)写出由A滴入沸水中制备B的离子方程式:
(3)兴趣小组讨论了多种使B转换为C的方法,请写出你认为可行的一种方法:
(4)下列说法正确的有(填序号):
①B转换为C的过程发生了化学反应
②由A制备B时,加热越久越好
③物质B具有丁达尔效应
④把B、C的混合物过滤,滤液无色透明
⑤整个系列反应,都不涉及氧化还原反应.
查看习题详情和答案>>

(1)写出A、B、C三种物质的名称:A
氯化铁溶液
氯化铁溶液
B氢氧化铁胶体
氢氧化铁胶体
C氢氧化铁沉淀
氢氧化铁沉淀
(2)写出由A滴入沸水中制备B的离子方程式:
Fe3++3H2O
Fe(OH)3(胶体)+3H+
| ||
Fe3++3H2O
Fe(OH)3(胶体)+3H+
;
| ||
(3)兴趣小组讨论了多种使B转换为C的方法,请写出你认为可行的一种方法:
加热或剧烈搅拌或加不与Fe(OH)3反应的强电解质(写一种即可)
加热或剧烈搅拌或加不与Fe(OH)3反应的强电解质(写一种即可)
; (4)下列说法正确的有(填序号):
③⑤
③⑤
.①B转换为C的过程发生了化学反应
②由A制备B时,加热越久越好
③物质B具有丁达尔效应
④把B、C的混合物过滤,滤液无色透明
⑤整个系列反应,都不涉及氧化还原反应.
某化学兴趣小组设计以下实验步骤与操作来定性检验茶叶中含有的少量钙、铁、铝三种元素.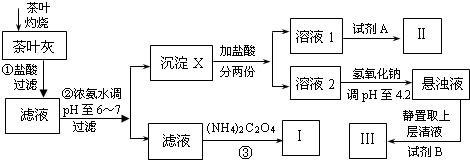
已知Ca2+、Al3+、Fe3+完全形成相应氢氧化物沉淀的pH如下表:
(1)步骤①中加入盐酸的作用是 .
(2)步骤②中调节pH至6~7的目的是 .
(3)沉淀X所含主要物质的化学式为 .
(4)写出步骤③中发生反应的离子方程式: .
(5)试剂A为 ;试剂B为铝试剂,加入该试剂后的实验现象是 .
查看习题详情和答案>>

已知Ca2+、Al3+、Fe3+完全形成相应氢氧化物沉淀的pH如下表:
| Ca(OH)2 | Al(OH)3 | Fe(OH)3 | |
| pH | ≥13 | ≥5.2 | ≥4.1 |
(2)步骤②中调节pH至6~7的目的是
(3)沉淀X所含主要物质的化学式为
(4)写出步骤③中发生反应的离子方程式:
(5)试剂A为