网址:http://m.1010jiajiao.com/timu3_id_413513[举报]
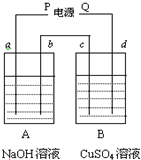 按右图装置实验,用惰性电极电解足量的NaOH溶液和足量CuSO4溶液.通电一段时间后,c极上有6.4gCu析出.
按右图装置实验,用惰性电极电解足量的NaOH溶液和足量CuSO4溶液.通电一段时间后,c极上有6.4gCu析出.(1)电源P为
(2)b极产生气体的体积为
(3)A烧杯溶液PH变化
(4)d极上所发生的电极反应式
| ||
| ||

(1)在上述溶解过程中,S2O32ˉ被氧化成SO42ˉ,LiCoO2在溶解过程中反应的离子方程式为
| 沉淀物 | 开始沉淀pH | 沉淀完全pH |
| Al(OH)3 | 3.0 | 5.2 |
| Fe(OH)3 | 1.5 | 2.8 |
| Fe(OH)2 | 7.6 | 9.7 |
AlO2-+CO2+2H2O═Al(OH)3↓+HCO3ˉ
AlO2-+CO2+2H2O═Al(OH)3↓+HCO3ˉ
(3)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如图乙.
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3.
①a中,阴极的电极反应式是
②b中,生成Li2CO3反应的化学方程式是
I、NaOH、FeCl3是中学化学实验室常用的试剂。
(1)在一定条件下能与NaOH溶液反应的固体单质有________和________(举两例)。
配制一定物质的量浓度的NaOH溶液时,造成实验结果偏低的原因是________。
A.容量瓶中原有少量蒸馏水
B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中;
C.定容时观察液面俯视
D.溶解后未经冷却立即转移至容量瓶内
(2)FeCl3可以腐蚀蚀刷电路铜板,反应的离子方程式为________________________________K2FeO4是一种强氧化剂,可作为水处理剂和高容量电池材料。K2FeO4可以由与FeCl3 与KClO在强碱性条件下反应制得,其反应的离子方程式为
______________________________________________.
Ⅱ丙烷在燃烧时能放如大量的热,它也是液化石油气的主要成分,作为能源应用于人们
的日常生产和生活。
已知:

(1)反应
(2)依据(1)中的反应可以设计一种新型燃料电池,一极通人空气,另一极通入丙烷气体:燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-。在电池内部O2-移向_________极(填“正”或“负”);电池的负极反应为_____________________________.
(3)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为_______________________________________________。
查看习题详情和答案>>
硼、镁及其化合物在工农业生产中应用广泛。
已知:硼镁矿主要成分为Mg2B2O5?H2O,硼砂的化学式为Na2B4O7?10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:

回答下列有关问题:
(1)硼砂中B的化合价为???????? ,溶于热水后,常用H2SO4调pH2~3制取H3BO3,反应的离子方程式为????????????? 。X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为??????????????? 。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是????????????????????????? ? 。若用惰性电极电解MgCl2溶液,其阴极反应式为 ??????????????? 。
(3)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+==Mg2++2H2O,则正极反应式为????????????????? 。若起始电解质溶液pH=1,则pH=2时溶液中Mg2+离子浓度为?????? 。已知Ksp[Mg(OH)2]=5.6 10-12,当溶液pH=6时?????? (填“有”或“没有”)Mg(OH)2沉淀析出。
10-12,当溶液pH=6时?????? (填“有”或“没有”)Mg(OH)2沉淀析出。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将??? 0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1 Na2S2O3(H2S2O3为弱酸)溶液滴定至终点,消耗Na2S2O3溶液18.00mL。盛装Na2S2O3溶液的仪器应为??????? 滴定管(填“酸式”或“碱式”)。该粗硼样品的纯度为 ???? 。(提示:I2+2S2O32-=2I-+S4O62-)
查看习题详情和答案>>