摘要:现有A.B.C.D.E.F六种短周期元素.它们的原子序数依次增大.D与E的氢化物分子构型都是V型.A.B原子的最外层电子数之和与C原子的最外层电子数相等.A能分别与B.C.D形成电子总数相等的分子.且A与D可形成的化合物常温下均为液态.请回答下列问题(填空时用实际物质的化学式表示): (1). 写出A.D两种元素组成的化合物的电子式 . , (2) .B与D一般情况下可形成两种常见气态化合物.它们是 . 假若现在科学家制出另一种直线型气态化合物 B2D2分子.且各原子最外层都满足8电子结构.则B2D2电子式为 (3). 最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子.C4分子结构如右图所示.已知断裂lmolC-C吸收167kJ热量.生成1mo1C三C放出942kJ热量.根据以上信息和数据.下列说法正确的是 . ① C4属于一种新型的化合物 ② C4沸点比P4低 ③ lmol C4气体转变为C2吸收882kJ热量 ④ C2与C4互为同素异形体 ⑤ C4稳定性比P4差 ⑥ C4与C2互为同分异构体 (4)已知 A2与C2一定条件下反应生成0.5moLAC3放出23kJ的热量.写出该反应的热化学方程式 . (5). C与F两种元素形成一种化合物分子.各原子最外层达8电子结构.则该分子的结构式为 .其空间构型为 . (6) .为了除去化合物乙(A2ED4),)稀溶液中混有的A2ED3.常加入氧化剂A2D2.发生反应的离子方程式为:
网址:http://m.1010jiajiao.com/timu3_id_413107[举报]
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子.
请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关):
(1)A~F六种元素原子,原子半径最大的是
(2)A、C、D三种元素组成的一种常见化合物,是重要的工业产品,该化合物电子式为: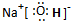
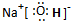 .
.
(3)B与F两种元素形成的一种化合物分子,各原子均达八电子结构,其中B显负价,F显正价,则该化合物水解的主要产物是:
(4)A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与铜反应,该反应的化学方程式为
查看习题详情和答案>>
请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关):
(1)A~F六种元素原子,原子半径最大的是
D
D
(填序号).(2)A、C、D三种元素组成的一种常见化合物,是重要的工业产品,该化合物电子式为:
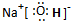
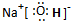
(3)B与F两种元素形成的一种化合物分子,各原子均达八电子结构,其中B显负价,F显正价,则该化合物水解的主要产物是:
HClO和NH3(NH3?H2O)
HClO和NH3(NH3?H2O)
.(4)A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与铜反应,该反应的化学方程式为
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
.
| ||
 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.请回答下列问题(填空时用实际符号):
(1)C的元素符号是
N
N
;元素F在周期表中的位置第3周期第ⅦA族
第3周期第ⅦA族
.(2)B与D一般情况下可形成两种常见气态化合物,假若现在科学家制出另一种直线型气态化合物 B2D2分子,且各原子最外层都满足8电子结构,则B2D2电子式为


分子晶体
分子晶体
.(3)最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子.C4分子结构如图所示,已知断裂1molC-C吸收167kJ热量,生成1molC=C放出942kJ热量.根据以上信息和数据,下列说法正确的是
②④⑦
②④⑦
.①C4属于一种新型的化合物
②C4沸点比P4(白磷)低
③lmol C4气体转变为C2吸收882kJ热量
④C4与C2互为同素异形体
⑤C4稳定性比P4(白磷)差
⑥C4属于原子晶体
⑦C4和P4 (白磷)的晶体都属于分子晶体
⑧C4与C2互为同分异构体
(4)C与F两种元素形成一种化合物分子,各原子最外层达8电子结构,则该分子的结构式为


三角锥型
三角锥型
.(5)为了除去化合物乙(A2ED4)稀溶液中混有的A2ED3,常采用A2D2为氧化剂,发生反应的离子方程式为:
H2O2+H2SO3=2H++SO42-+H2O
H2O2+H2SO3=2H++SO42-+H2O
(6)E与F形成的化合物E2F2在橡胶工业上有重要用途,遇水易水解,其空间结构与A2D2极为相似.对此以下说法正确的是
acd
acd
.a.E2F2的结构式为:F-E-E-F
b.E2F2为含有极性键 和非极性键的非极性分子
c.E2Br2与E2F2结构相似,熔沸点:E2Br2>E2F2
d.E2F2与H2O反应的化学方程式可能为:2E2F2+2H2O=EO2↑+3E↓+4HF
(7)举出一种事实说明E与F的非金属性强弱(用化学方程式或用语言文字表达均可):
C12+H2S=S↓+2HCl
C12+H2S=S↓+2HCl
. 现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E同主族,且D的氢化物常温时为液态.A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C、D形成电子总数相等的分子.
现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E同主族,且D的氢化物常温时为液态.A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C、D形成电子总数相等的分子.(1)C的元素符号是
N
N
;B的最高价氧化物的电子式为

第三周期第ⅦA族
第三周期第ⅦA族
.(2)B、C、D元素的氢化物的沸点由商到低的顺序为
H2O>NH3>CH4
H2O>NH3>CH4
(用化学式表示).(3)将足量D的单质通入到A2E的溶液中,反应的化学方程式为
2H2S+O2=2S↓+2H2O
2H2S+O2=2S↓+2H2O
(4)最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4气态分子.C4分子结构如图所示,已知断裂1molC-C吸收l67KJ的热量,生成1mol C≡C放出942KJ热量.试写出由C4气态分子变成C2气态分子的热化学方程式:
N4(g)=2N2(g)△H=-882kJ/mol
N4(g)=2N2(g)△H=-882kJ/mol
.(5)某盐x(C2A6F2)的性质与CA4F类似,是离子化合物,其水溶液因分步水解而呈弱酸性.
①盐x显酸性原因(用离子方程式表示)
N2H62++H2O?[N2H5?H2O]++H+
N2H62++H2O?[N2H5?H2O]++H+
.②写出足量金属镁加入盐x的溶液中产生H2的记学方程式为
Mg+N2H6Cl2=MgCl2+N2H4+H2↑
Mg+N2H6Cl2=MgCl2+N2H4+H2↑
.现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大.室温下E元素的单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜;D元素原子核外M电子层与K电子层上的电子数相等;A可分别与B、F形成A2B,A2B2、AF等共价化合物;C可分别与B、F形成C2B、C2B2、CF等离子化合物.
请回答下列问题:
(1)以上六种元素中,金属性最强的是(填元素符号)
 .
.
(2)以上元素形成的简单离子中,核外电子数相等的是(填真实的离子符号)
(3)C2B2的电子式为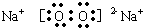
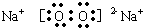 ,该物质中存在的化学键有
,该物质中存在的化学键有
(4)A2B与C2B2反应的化学方程式是
查看习题详情和答案>>
请回答下列问题:
(1)以上六种元素中,金属性最强的是(填元素符号)
Na
Na
,F原子的结构示意图为

(2)以上元素形成的简单离子中,核外电子数相等的是(填真实的离子符号)
O2-、Na+、Mg2+、Al3+
O2-、Na+、Mg2+、Al3+
.(3)C2B2的电子式为
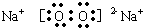
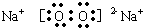
离子键、非极性键(或共价键)
离子键、非极性键(或共价键)
.(4)A2B与C2B2反应的化学方程式是
2H2O+2Na2O2=4NaOH+O2↑
2H2O+2Na2O2=4NaOH+O2↑
.现有A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大,已知A、D位于同一主族,A元素在元素周期表中原子半径最小,C是非金属性最强的元素,B、E原子最外层电子数相等,且B、E原子序数之和是A、D原子序数之和的两倍,F的最高价氧化物对应的水化物酸性最强.
(1)请在如图塔式元素周期表(元素周期表的另一种画法)相应位置中标出B元素的元素符号,同时在图中将过渡元素涂黑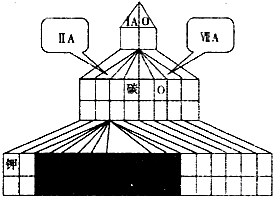
 .
.
(2)D元素的简单离子的离子结构示意图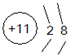
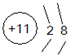
(3)B、E形成的气态氢化物的熔沸点那个高
(4)E与C或F均能形成一些化合物,据有关资料E与C能形成化合物EC6,E能与F能形成化合物E2F2.请回答下面问题:
①甲同学通过分析认为EC6此物质不可能在O2中燃烧,原因是:
②乙同学通过查资料知化合物E2F2中既存在极性键,又存在非极性键,试写出其电子式:
 ;该物质遇水不稳定,生成一种黄色沉淀和无色气体,还得到一种酸性溶液.试写出该过程的反应方程式
;该物质遇水不稳定,生成一种黄色沉淀和无色气体,还得到一种酸性溶液.试写出该过程的反应方程式
查看习题详情和答案>>
(1)请在如图塔式元素周期表(元素周期表的另一种画法)相应位置中标出B元素的元素符号,同时在图中将过渡元素涂黑


(2)D元素的简单离子的离子结构示意图
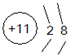
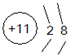
(3)B、E形成的气态氢化物的熔沸点那个高
H2O
H2O
,(用具体的化学式表示).(4)E与C或F均能形成一些化合物,据有关资料E与C能形成化合物EC6,E能与F能形成化合物E2F2.请回答下面问题:
①甲同学通过分析认为EC6此物质不可能在O2中燃烧,原因是:
硫在SF6中显+6价不可再升,O2不可将负一价氟氧化
硫在SF6中显+6价不可再升,O2不可将负一价氟氧化
,②乙同学通过查资料知化合物E2F2中既存在极性键,又存在非极性键,试写出其电子式:


2S2Cl2+2H2O=4HCl+SO2↑+3S↓
2S2Cl2+2H2O=4HCl+SO2↑+3S↓
.