摘要:20.能源是国民经济发展的重要基础.我国目前使用的能源主要是化石燃料. (1)在25 ℃.101 kPa时.16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ. 则CH4燃烧的热化学方程式是 . + O2(g) CO2(g) ΔH=-437.3 kJ•mol-1 H2(g) + O2(g) H2O(g) ΔH=-285.8 kJ•mol-1 CO(g) + O2(g) CO2(g) ΔH=-283.0 kJ•mol-1 则煤的气化主要反应的热化学方程式是 C(s) + H2O(g) CO(g) + H2(g) ΔH= kJ•mol-1.
网址:http://m.1010jiajiao.com/timu3_id_412828[举报]
 能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料.
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料. (1)已知碳的燃烧热△H=-393.5KJ/mol,完全燃烧10mol碳释放的热量为
3935
3935
KJ.(2)实验测得6.4g 乙醇在氧气中充分燃烧生成CO2(g)和H2O(l)时释放出113.5KJ的热量,试写出乙醇燃烧热的热化学方程式:
CH3CH2OH(l)+3O2(g)=2 CO2(g)+3H2O(l)△H=-816.5 kJ/mol
CH3CH2OH(l)+3O2(g)=2 CO2(g)+3H2O(l)△H=-816.5 kJ/mol
(3)从化学键的角度分析,化学反应的实质就是反应物的化学键的断裂和生成物的化学键的形成过程.已知H-H键能为436KJ/mol,H-N键能为391KJ/mol,根据化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,则 N≡N 键的键能是
945.6
945.6
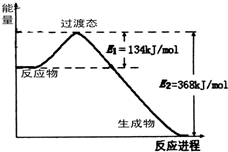
KJ/mol(4)如图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol
.在反应体系中加入催化剂,E1的变化是减小
减小
(填“增大”、“减小”或“不变”),对反应热是否有影响?无
无
,原因是反应热的大小只与反应物和生成物所具有的总能量有关
反应热的大小只与反应物和生成物所具有的总能量有关
(5)根据以下3个热化学方程式,判断Q1、Q2、Q3三者大小关系是
Q1<Q2<Q3
Q1<Q2<Q3
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=Q1kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(l)△H=Q2kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(g)△H=Q3kJ/mol.
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料.
(1)在25℃、101kPa时,16g CH4完全燃烧生成液态水时放出的热量是890.31kJ,则CH4燃烧的热化学方程式是
(2)已知:C(s)+O2(g) CO2(g)△H=-437.3kJ?mol-1
H2(g)+
O2(g) H2O(g)△H=-285.8kJ?mol-1
CO(g)+
O2(g) CO2(g)△H=-283.0kJ?mol-1
则煤的气化主要反应的热化学方程式是:C(s)+H2O(g)═CO(g)+H2(g)
△H=
查看习题详情和答案>>
(1)在25℃、101kPa时,16g CH4完全燃烧生成液态水时放出的热量是890.31kJ,则CH4燃烧的热化学方程式是
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.31KJ/mol
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.31KJ/mol
.(2)已知:C(s)+O2(g) CO2(g)△H=-437.3kJ?mol-1
H2(g)+
| 1 |
| 2 |
CO(g)+
| 1 |
| 2 |
则煤的气化主要反应的热化学方程式是:C(s)+H2O(g)═CO(g)+H2(g)
△H=
131.5
131.5
kJ?mol-1.如果该反应△S=+133.7J?K-1?mol-1该反应在常温下能否自发进行?不能
不能
(填“能”或“不能”).能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25 ℃、101 kPa时,8 g CH4完全燃烧生成液态水时放出的热量是445.15 kJ,则CH4燃烧的热化学方程式是 。
(2)已知:C(s) + O2(g)  CO2(g) ΔH=-437.3 kJ?mol-1
CO2(g) ΔH=-437.3 kJ?mol-1
H2(g) + 1/2 O2(g)  H2O(g) ΔH=-285.8 kJ?mol-1
H2O(g) ΔH=-285.8 kJ?mol-1
CO(g) + 1/2 O2(g)  CO2(g) ΔH=-283.0 kJ?mol-1
CO2(g) ΔH=-283.0 kJ?mol-1
则煤的气化主要反应的热化学方程式是:C(s) + H2O(g)  CO(g) + H2(g) ΔH= kJ?mol-1。如果该反应ΔS=+133.7 J·K-1·mol-1 该反应在常温(25 ℃)下能否自发进行?(△G=△H-T△S) (填“能”或“不能”,并写出判断依据).
CO(g) + H2(g) ΔH= kJ?mol-1。如果该反应ΔS=+133.7 J·K-1·mol-1 该反应在常温(25 ℃)下能否自发进行?(△G=△H-T△S) (填“能”或“不能”,并写出判断依据).
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ·mol-1 | 436 | 391 | 945 |
 2NH3 △H="a" kJ·mol-1。试根据表中所列键能数据估算a的数值为 。
查看习题详情和答案>>
2NH3 △H="a" kJ·mol-1。试根据表中所列键能数据估算a的数值为 。
查看习题详情和答案>>
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25 ℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4燃烧的热化学方程式是_______________ 。
(2)已知:C(s) + O2(g)== CO2(g) ΔH=-437.3 kJ·mol-1
H2(g) + O2(g)== H2O(g) ΔH=-285.8 kJ·mol-1
CO(g) + O2(g)== CO2(g) ΔH=-283.0 kJ·mol-1
则煤的气化主要反应的热化学方程式是 C(s) + H2O(g)== CO(g) + H2(g) ΔH=___________kJ·mol-1。
查看习题详情和答案>>
(1)在25 ℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4燃烧的热化学方程式是_______________ 。
(2)已知:C(s) + O2(g)== CO2(g) ΔH=-437.3 kJ·mol-1
H2(g) + O2(g)== H2O(g) ΔH=-285.8 kJ·mol-1
CO(g) + O2(g)== CO2(g) ΔH=-283.0 kJ·mol-1
则煤的气化主要反应的热化学方程式是 C(s) + H2O(g)== CO(g) + H2(g) ΔH=___________kJ·mol-1。
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4燃烧的热化学方程式为_______________________________。
(2)已知:
C(s)+O2(g)===CO2(g);ΔH=-437.3 kJ·mol-1
H2(g)+1/2O2(g)===H2O(g);ΔH=-285.8 kJ·mol-1
CO(g)+1/2O2(g)===CO2(g);ΔH=-283.0 kJ·mol-1
则煤气化反应C(s)+H2O(g)===CO(g)+H2(g) 的焓变ΔH=________kJ·mol-1。
(3)如下图所示组成闭合回路,其中,甲装置中CH4为负极,O2和CO2的混合气体为正极,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为200 mL。
(1)在25℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4燃烧的热化学方程式为_______________________________。
(2)已知:
C(s)+O2(g)===CO2(g);ΔH=-437.3 kJ·mol-1
H2(g)+1/2O2(g)===H2O(g);ΔH=-285.8 kJ·mol-1
CO(g)+1/2O2(g)===CO2(g);ΔH=-283.0 kJ·mol-1
则煤气化反应C(s)+H2O(g)===CO(g)+H2(g) 的焓变ΔH=________kJ·mol-1。
(3)如下图所示组成闭合回路,其中,甲装置中CH4为负极,O2和CO2的混合气体为正极,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为200 mL。
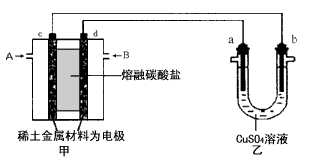
①甲装置中气体A为_____ (填“CH4”或“O2和CO2”),d极上的电极反应式为_____________。
②乙装置中a极上的电极反应式为____________________________。若在a极产生112mL(标准状况)气体,则甲装置中消耗CH4________ mL (标准状况),乙装置中所得溶液的pH=__________。(忽略电解前后溶液体积变化)
③如果乙中电极不变,将溶液换成饱和Na2SO4溶液,当阴极上有a mol气体生成时,同时有w g Na2SO4·10H2O晶体析出,若温度不变,剩余溶液中溶质的质量分数应为________(用含w、a的表达式表示,不必化简)。
查看习题详情和答案>>
②乙装置中a极上的电极反应式为____________________________。若在a极产生112mL(标准状况)气体,则甲装置中消耗CH4________ mL (标准状况),乙装置中所得溶液的pH=__________。(忽略电解前后溶液体积变化)
③如果乙中电极不变,将溶液换成饱和Na2SO4溶液,当阴极上有a mol气体生成时,同时有w g Na2SO4·10H2O晶体析出,若温度不变,剩余溶液中溶质的质量分数应为________(用含w、a的表达式表示,不必化简)。