摘要:针对下列平衡体系回答问题Fe3+ + 3H2O Fe(OH)3 + 3H+ 条件 移动方向 H+数 PH Fe3+水解率 现象 升温 通HCl 加H2O 加NaHCO3 加FeCl3
网址:http://m.1010jiajiao.com/timu3_id_412633[举报]
已知溴乙烷跟氰化钠反应后,产物再水解可以得到丙酸:CH3CH2Br+NaCN→CH3CH2CN+NaBr,CH3CH2CN+H2O→CH3CH2COOH+NH3(未配平).产物分子比原化合物分子多了一个碳原子,增长了碳链.请根据下列转化关系回答问题.其中F分子中含有一个由8个原子组成的环状结构.
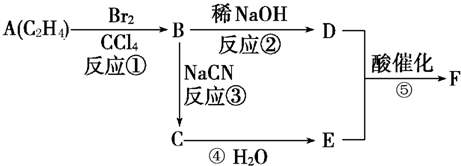
(1)反应①、②、③中属于取代反应的是
(2)B的名称为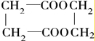
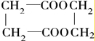 ;
;
(3)写出D和E在一定条件下发生聚合反应的产物(用结构简式表示)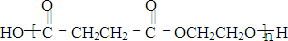
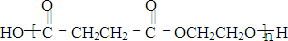 ;
;
(4)E的同系物中碳原子数最少的为
查看习题详情和答案>>

(1)反应①、②、③中属于取代反应的是
②③
②③
(填反应代号);(2)B的名称为
1,2-二溴乙烷
1,2-二溴乙烷
;E和F的结构简式为:EHOOCCH2CH2COOH
HOOCCH2CH2COOH
,F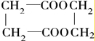
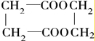
(3)写出D和E在一定条件下发生聚合反应的产物(用结构简式表示)
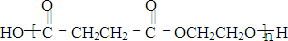
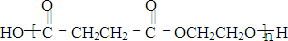
(4)E的同系物中碳原子数最少的为
2
2
,请设计合理方案:由D合成该物质(要求:用化学方程式表示)CH2OH-CH2OH+O2
OHC-CHO+2H2O,OHC-CHO+O2
HOOCCOOH
| Cu |
| △ |
| 催化剂 |
| △ |
CH2OH-CH2OH+O2
OHC-CHO+2H2O,OHC-CHO+O2
HOOCCOOH
.| Cu |
| △ |
| 催化剂 |
| △ |
I.根据下列化学方程式回答问题:
SiO2+2C+2Cl
SiCl4+2CO
(1)12gC参与反应时电子转移的数目是
II.请写出下列反应的化学方程式或离子方程式.
(1)在制作印刷电路板的过程中常利用铜与氯化铁溶液反应的离子方程式
(2)利用铝与二氧化锰反应来制取高熔点金属锰的化学方程式
III.某化学兴趣小组拟从海带中提取碘,进行如下实验:干海带
海带灰
浸泡液
I2(CCL4)→I2
从A~C中选择适当的装置填空(填字母):

(1)过滤操作时用到的装置是
(2)从I2的CCl4溶液中提取单质I2并回收CCl4的可用装置
查看习题详情和答案>>
SiO2+2C+2Cl
| ||
(1)12gC参与反应时电子转移的数目是
2NA
2NA
.(2)在该反应中,氧化剂是Cl2
Cl2
.II.请写出下列反应的化学方程式或离子方程式.
(1)在制作印刷电路板的过程中常利用铜与氯化铁溶液反应的离子方程式
2Fe3++Cu=2Fe2++Cu2+
2Fe3++Cu=2Fe2++Cu2+
.(2)利用铝与二氧化锰反应来制取高熔点金属锰的化学方程式
4Al+3MnO2
2Al2O3+3Mn
| ||
4Al+3MnO2
2Al2O3+3Mn
.
| ||
III.某化学兴趣小组拟从海带中提取碘,进行如下实验:干海带
| 灼烧 |
| ||
| 过滤 |
| ||
| 萃取分液 |
从A~C中选择适当的装置填空(填字母):

(1)过滤操作时用到的装置是
C
C
.(2)从I2的CCl4溶液中提取单质I2并回收CCl4的可用装置
A
A
.阅读下列材料后回答问题
一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+ 和Fe3+的形式存在.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁.服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收.
(1)在人体中进行Fe2+→Fe3+的转化时,Fe2+作
(2)“服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话指出,维生素C在这一反应中作
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分时盐酸)的作用下转化成亚铁盐.此反应的化学方程式为
查看习题详情和答案>>
一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+ 和Fe3+的形式存在.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁.服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收.
(1)在人体中进行Fe2+→Fe3+的转化时,Fe2+作
还原
还原
剂,Fe3+→Fe2+转化时,Fe3+作氧化
氧化
剂.(2)“服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话指出,维生素C在这一反应中作
还原
还原
剂.(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分时盐酸)的作用下转化成亚铁盐.此反应的化学方程式为
Fe+2HCl=FeCl2+H2↑
Fe+2HCl=FeCl2+H2↑
. (2013?无锡一模)溴苯是一种化工原料,实验室合成溴体的装置示意图及有关数据如下:
(2013?无锡一模)溴苯是一种化工原料,实验室合成溴体的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g?cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白色烟雾产生,是因为生成了
HBr
HBr
气体.继续滴加至液溴滴完.装置d的作用是吸收HBr和Br2
吸收HBr和Br2
;(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL 10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是
除去HBr和未反应的Br2
除去HBr和未反应的Br2
;③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是
干燥
干燥
;(3)经以上分离操作后,粗溴苯中还含有的主要杂质为
苯
苯
,要进一步提纯,下列操作中必须的是C
C
;(填入正确选项前的字母)A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是
B
B
.(填入正确选项前的字母)A.25mL B.50mL C.250mL D.500mL.