摘要: (1)A中加入的物质是 . 发生反应的化学方程式是 ; (2)B中加入的物质是 .其作用是 (3)实验时在C中观察到得现象是 . 发生反应的化学方程式是 ; (4) 实验时在D中观察到得现象是 . D中收集到的物质是 检验该物质的方法和现象是 .
网址:http://m.1010jiajiao.com/timu3_id_412552[举报]
化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,这些废液必须经处理后才能排放.某化学实验室产生的废液中含有两种金属离子:Fe3+、Cu2+,化学小组设计了如图所示的方案对废液进行处理,以回收金属,保护环境.
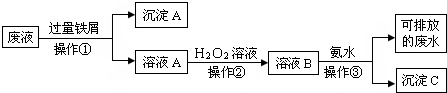
(1)操作①的名称是
(2)操作②反应时还需加入少量硫酸,操作②中观察到的实验现象是
(3)操作②中发生反应的离子方程式为
(4)简述以沉淀A为原料制得金属铜和绿矾晶体(FeSO4?7H2O)的实验方案
查看习题详情和答案>>

(1)操作①的名称是
过滤
过滤
.(2)操作②反应时还需加入少量硫酸,操作②中观察到的实验现象是
溶液由浅绿色变为棕黄色,有少量气泡出现
溶液由浅绿色变为棕黄色,有少量气泡出现
.(3)操作②中发生反应的离子方程式为
2Fe2++H2O2+2H+=2Fe3++H2O
2Fe2++H2O2+2H+=2Fe3++H2O
.(4)简述以沉淀A为原料制得金属铜和绿矾晶体(FeSO4?7H2O)的实验方案
在沉淀中加入稀硫酸,搅拌,至不再有气泡产生,过滤,洗涤固体并干燥得铜.滤液加热浓缩后冷却结晶,过滤,干燥得绿矾.
在沉淀中加入稀硫酸,搅拌,至不再有气泡产生,过滤,洗涤固体并干燥得铜.滤液加热浓缩后冷却结晶,过滤,干燥得绿矾.
. 化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.Ⅰ(1)在298K、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量.则表示氢气燃烧热的热化学方程式为:
H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol
| 1 |
| 2 |
H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol
.| 1 |
| 2 |
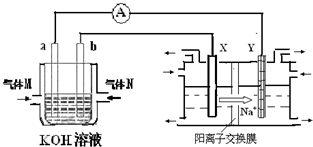
氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行下图饱和食盐水电解实验(图中所用电极均为惰性电极).分析该装置、回答下列问题:
(2)氢氧燃料电池中,a电极为电池的是
负极
负极
(填“正极”或“负极”),气体M的分子式H2
H2
,a电极上发生的电极反应式为:H2+OH--2e-=2H2O
H2+OH--2e-=2H2O
.(3)若右上图装置中盛有100mL5.0mol/LNaCl溶液,电解一段时间后须加入10.0mol/L盐酸溶液50mL(密度为1.02g/mL)才能使溶液恢复至原来状态.则在此电解过程中导线上转移的电子数为
4.14
4.14
mol.(保留小数点后2位)Ⅱ氢气是合成氨的重要原料.工业上合成氨的反应是:
N2(g)+3H2(g)?2NH3 (g)△H=-92.2kJ?mol-1
(4)下列事实中,不能说明上述可逆反应已经达到平衡的是
③④
③④
.①N2、H2、NH3的体积分数不再改变;
②单位时间内生成2n mol NH3的同时生成3n mol H2;
③单位时间内生成3n mol N-H键的同时生成n mol N≡N;
④用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2;
⑤混合气体的平均摩尔质量不再改变;
⑥混合气体的总物质的量不再改变.
(5)已知合成氨反应在某温度下2.00L的密闭容器中反应,测得如下数据:
| 物质的量/(mol)/时间(h) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
①反应进行到2小时时放出的热量为
27.7
27.7
kJ.②0~1小时内N2的平均反应速率
0.05
0.05
mol?L-1?h-1.③此条件下该反应的化学平衡常数K═
0.15
0.15
(保留两位小数).④反应达到平衡后,若往平衡体系中再加入N2、H2 和NH3各1mol,化学平衡向
正反应
正反应
方向移动(填“正反应”或“逆反应”或“不移动”.) 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.I.氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图实验(图中所用电极均为惰性电极):
(1)对于氢氧燃料电池中,下列表达不正确的是
CD
CD
A.a电极是负极,OH-移向负极
B.b电极的电极反应为:O2+2H2O+4e-=4OH-
C.电池总反应式为:2H2+O2
| ||
D.电解质溶液的pH保持不变
E.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)上图装置中盛有100mL、0.1mol?L-1AgNO3溶液,当氢氧燃料电池中消耗氢气112mL(标准状况下)时,则此时上图装置中溶液的pH=
1
1
(溶液体积变化忽略不计)II氢气是合成氨的重要原料.工业上合成氨的反应是:N2(g)+3H2(g)?2NH3(g)△H=-92.20kJ?mol-1.
(1)下列事实中,不能说明上述可逆反应已达到平衡的是
②③
②③
(填序号)①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成n mol N-H的同时生成n mol N≡N
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
④N2、H2、NH3的体积分数不再改变
⑤混合气体的平均摩尔质量不再改变
⑥混合气体的总物质的量不再改变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
时间(h) 物质的量(mol) |
0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | N2 | 1.00 | 1.00 |
①反应进行到2小时时放出的热量为
27.66kJ
27.66kJ
②此条件下该反应的化学平衡常数K=
| 4 |
| 27 |
| 4 |
| 27 |
③反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向
正反应
正反应
方向移动(填“正反应”或“逆反应”、“不移动”).