摘要:28. (1)F物质的化学式为 , J物质的化学式为 , I物质的电子式为 , (2)写出I催化氧化的化学方程式: , (3)写出⑥的化学方程 式: .
网址:http://m.1010jiajiao.com/timu3_id_412551[举报]
物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中气体D、H为单质,试回答: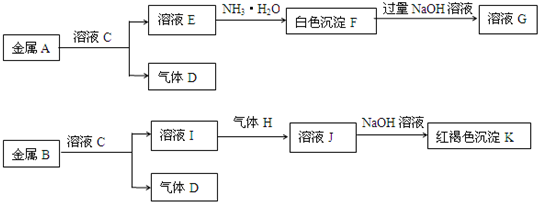
(1)写出下列物质的化学式:A是
(2)写出反应“E→F”的离子方程式:
(3)写出反应“F→G”的离子方程式:
(4)写出反应“I→J”的离子方程式:
查看习题详情和答案>>

(1)写出下列物质的化学式:A是
Al
Al
,B是Fe
Fe
,C是HCl
HCl
,K是Fe(OH)3
Fe(OH)3
.(2)写出反应“E→F”的离子方程式:
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
;(3)写出反应“F→G”的离子方程式:
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
;(4)写出反应“I→J”的离子方程式:
2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
.物质A、B、C、D、E、F、G、H、I、J、K有下图转化关系,其中气体D、E为单质,按要求回答下列问题.

(1)金属A元素在周期表的位置是
(2)写出反应“C→F”的离子方程式
(3)写出反应“I→J”的离子方程式
(4)写出F与NaOH溶液反应生成G的化学方程式
查看习题详情和答案>>

(1)金属A元素在周期表的位置是
第3周期第ⅢA族
第3周期第ⅢA族
,G的化学式是NaAlO2
NaAlO2
.(2)写出反应“C→F”的离子方程式
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
;(3)写出反应“I→J”的离子方程式
2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
;(4)写出F与NaOH溶液反应生成G的化学方程式
Al(OH)3+NaOH═NaAlO2+2H2O
Al(OH)3+NaOH═NaAlO2+2H2O
.物质A、E、F的焰色反应呈黄色,物质I的分子由4个原子组成并共含有10个电子,B、C、D、K在常温下都是气体单质,G在常温下是无色液体,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如图所示:

请填写下列空白:
(1)写出下列物质的化学式:B:
(2)写出下列反应的方程式:①反应①的离子方程式:
(3)在通常状况下,若1g C气体在B气体中燃烧生成H气体时放出92.3kJ热量,则2mol H气体完全分解生成C气体和B气体的热化学方程式为:
查看习题详情和答案>>

请填写下列空白:
(1)写出下列物质的化学式:B:
Cl2
Cl2
;J:NO
NO
.(2)写出下列反应的方程式:①反应①的离子方程式:
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
;②反应⑤的化学方程式:4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
(3)在通常状况下,若1g C气体在B气体中燃烧生成H气体时放出92.3kJ热量,则2mol H气体完全分解生成C气体和B气体的热化学方程式为:
2HCl(g)=H2(g)+Cl2(g);△H=+184.6kJ?mol-1
2HCl(g)=H2(g)+Cl2(g);△H=+184.6kJ?mol-1
.物质A、B、C、D、E、F、G、H、I、J、K有下图转化关系,其中气体D、E为单质,
请按要求回答下列问题.
(1)组成金属A的元素在周期表的位置是
(2)写出反应“C→F”的离子方程式
(3)写出反应“I→J”的离子方程式
(4)写出金属 H与水蒸气在高温下反应的化学方程式
查看习题详情和答案>>

请按要求回答下列问题.
(1)组成金属A的元素在周期表的位置是
第3周期ⅢA族
第3周期ⅢA族
,D的化学式是H2
H2
(2)写出反应“C→F”的离子方程式
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
;(3)写出反应“I→J”的离子方程式
2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
;(4)写出金属 H与水蒸气在高温下反应的化学方程式
3Fe+4H2O(g)
Fe3O4+4H2
| ||
3Fe+4H2O(g)
Fe3O4+4H2
.
| ||
物质A~X有如图所示的转化关系(部分反应物、生成物及反应条件没有列出).其中B、C、D为常见单质,C为气体,B、D为金属.常温下K为气体,且能使品红溶液褪色.将E的饱和溶液滴入沸水可制得一种红褐色胶体;J为红棕色固体,F为常见的强酸.
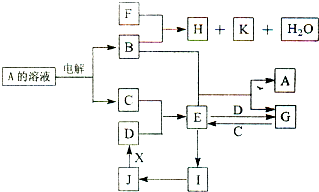
请回答下列问题:
(1)组成C的元素在周期表的位置是 ;B与F反应的化学方程式为 .
(2)实现J→D的变化:若X是非金属固体单质,则X是 (填化学式);若X是常见金属单质,请写出此反应的化学方程式: .
(3)含杂质的D在潮湿的空气中易发生吸氧腐蚀,其正极的电极反应式为 .
(4)室温时,若A的溶液pH=5,则溶液中水电离的c(H+)= mol/L,若用惰性电极电解析出3.2g B,则反应中转移电子的物质的量为 mol.
查看习题详情和答案>>

请回答下列问题:
(1)组成C的元素在周期表的位置是
(2)实现J→D的变化:若X是非金属固体单质,则X是
(3)含杂质的D在潮湿的空气中易发生吸氧腐蚀,其正极的电极反应式为
(4)室温时,若A的溶液pH=5,则溶液中水电离的c(H+)=