摘要:第Ⅱ卷 21.某研究性学习小组进行SO2的制备的性质试验探究: ⑴当用过量的铁粉与浓硫酸在加热条件下进行反应时.发现生成的气体冷却后体积比理论计算所得的SO2的体积要多.请你说明可能的原因.并说明验证的方法. 可能原因: 验证方法 : ⑵当铜与浓硫酸在加热制备SO2时.发现铜和浓硫酸反应后没有得到预期的蓝色溶液.而是白色沉淀.请你推测产生此现象的可能原因: 可能原因:① ② 验证白色沉淀成分的方法:
网址:http://m.1010jiajiao.com/timu3_id_412514[举报]
铁是人类较早使用的金属之一.运用所学知识,回答下列问题.
(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是 .
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式: .
(3)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是 ;②溶液组成的测定:取50.0mL待测溶液,加入足量的AgNO3溶液,得21.525g白色沉淀.则溶液中c(Cl-)= mol?L-1.
③验证该溶液中含有Fe2+,正确的实验方法是 .
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.取适量溶液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(4)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如图方案:

①滤渣C的化学式为 .
②加过量D发生反应的离子方程式为 .
③通入F发生反应的化学方程式为 .
查看习题详情和答案>>
(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
(3)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是
③验证该溶液中含有Fe2+,正确的实验方法是
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.取适量溶液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(4)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如图方案:

①滤渣C的化学式为
②加过量D发生反应的离子方程式为
③通入F发生反应的化学方程式为
锂离子电池的广泛应用使回收利用锂货源成为重要课题:某研究性学习小组对废旧锂离子电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)进行资源回收研究,设计实验流程如下: [来源:学#科#网]
[来源:学#科#网]
(1)第②步反应得到的沉淀X的化学式为 。
(2)第③步反应的离子方程式是 。
(3)第④步反应后,过滤Li2CO3所需的玻璃仪器有 。
若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:
、 ![]() 。
。
(4)若废旧锂离子电池正极材料含LiNB2O4的质量为18.1 g第③步反应中加入20.0mL3.0mol·L-1的H2SO4溶液。定正极材料中的锂经反应③和④完全为Li2CO3,剩至少有 Na2CO3参加了反应。
查看习题详情和答案>>(2013?青岛一模)(Ⅰ)铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
(1)固体A用稀盐酸溶解的原因是
(2)检验溶液B中是否存在Fe3+的方法是
(3)已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是
(Ⅱ)(1)常温下,某同学将稀盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
请回答:从第①组情况分析,该组所得混合溶液中由水电离出的c(H+)=
从第③组情况分析可知,混合溶液中c(NH4+)
(2)写出以下四组溶液NH4+离子浓度由大到小的顺序
A.0.1mol?L-1 NH4Cl B.0.1mol?L-1 NH4Cl和0.1mol?L-1 NH3?H2O
C.0.1mol?L-1 NH3?H2O D.0.1mol?L-1NH4Cl和0.1mol?L-1 HCl.
查看习题详情和答案>>
(1)固体A用稀盐酸溶解的原因是
防止铁盐、铜盐发生水解反应
防止铁盐、铜盐发生水解反应
;(2)检验溶液B中是否存在Fe3+的方法是
取少量溶液B,滴加几滴KSCN溶液,若无明显现象则溶液中无Fe3+,若溶液变红色,则存在Fe3+
取少量溶液B,滴加几滴KSCN溶液,若无明显现象则溶液中无Fe3+,若溶液变红色,则存在Fe3+
;(3)已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是
2Cu2++SO32-+2Cl-+H2O
2CuCl↓+SO42-+2H+
| ||
2Cu2++SO32-+2Cl-+H2O
2CuCl↓+SO42-+2H+
;
| ||
(Ⅱ)(1)常温下,某同学将稀盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
| 实验编号 | 氨水物质的量浓度 (mol?L-1) |
盐酸物质的量浓度 (mol?L-1) |
混合溶液pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | C | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH>7 |
1×10-5 mol?L-1
1×10-5 mol?L-1
mol?L-1;从第②组情况表明,C>
>
0.2mol?L-1(选填“>”、“<”或“=”);从第③组情况分析可知,混合溶液中c(NH4+)
>
>
c(NH3?H2O)(选填“>”、“<”或“=”).(2)写出以下四组溶液NH4+离子浓度由大到小的顺序
B
B
>D
D
>A
A
>C
C
(填选项编号).A.0.1mol?L-1 NH4Cl B.0.1mol?L-1 NH4Cl和0.1mol?L-1 NH3?H2O
C.0.1mol?L-1 NH3?H2O D.0.1mol?L-1NH4Cl和0.1mol?L-1 HCl.
现有含CaO杂质的CaC2试样.某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度(固体电石--CaC2与水可快速反应生成难溶于水的C2H2,反应方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑).请填写下列空白:
Ⅰ、第一种方案:请从图中选用适当的装置,设计一个实验,测定CaC2试样的纯度.

(1)制取C2H2最好选④中的
(2)若实验时称取的试样为1.4g,产生的乙炔在标准状况下的体积为448mL,此试样中CaC2的质量分数为
Ⅱ、第二种方案:根据试样和水在锥形瓶中反应前后质量的变化,测定CaC2的质量分数.先称取试样1.6g、锥形瓶和水的质量为195.0g,再将试样加入锥形瓶中,反应过程中每隔相同时间测得的数据如下表:
(3)计算CaC2的质量分数时,必需用的数据是
Ⅲ、第三种方案:称取一定质量的试样(1.6g),操作流程如下:

(4)操作Ⅱ的名称是
(5)要测定CaC2试样的纯度,还需知道的数据是
(6)在转移溶液时,如溶液转移不完全,则CaC2质量分数的测定结果
查看习题详情和答案>>
Ⅰ、第一种方案:请从图中选用适当的装置,设计一个实验,测定CaC2试样的纯度.

(1)制取C2H2最好选④中的
丙
丙
.所选用装置的连接顺序是(填各接口A~E的顺序):E、C、D、B
E、C、D、B
.(2)若实验时称取的试样为1.4g,产生的乙炔在标准状况下的体积为448mL,此试样中CaC2的质量分数为
91.4%
91.4%
.Ⅱ、第二种方案:根据试样和水在锥形瓶中反应前后质量的变化,测定CaC2的质量分数.先称取试样1.6g、锥形瓶和水的质量为195.0g,再将试样加入锥形瓶中,反应过程中每隔相同时间测得的数据如下表:
| 读数次数 | 质量/g | |
锥形瓶十水十试样 |
第1次 | 196.4 |
| 第2次 | 196.2 | |
| 第3次 | 196.1 | |
| 第4次 | 196.0 | |
| 第5次 | 196.0 |
试样质量、锥形瓶和水的质量、第4、5次读数
试样质量、锥形瓶和水的质量、第4、5次读数
.不必作第6次读数的原因是第4、5次实验读数相同,表明锥形瓶内质量已达恒重,反应进行完全
第4、5次实验读数相同,表明锥形瓶内质量已达恒重,反应进行完全
.Ⅲ、第三种方案:称取一定质量的试样(1.6g),操作流程如下:

(4)操作Ⅱ的名称是
蒸发
蒸发
.(5)要测定CaC2试样的纯度,还需知道的数据是
CaCl2质量
CaCl2质量
.(6)在转移溶液时,如溶液转移不完全,则CaC2质量分数的测定结果
偏大
偏大
(填“偏大”、“偏小”或“不变”).某研究性学习小组,用下列仪器、药品验证合金(由Cu、Fe、Zn三种物质组成)和适量浓硝酸反应产生的气体中含NO(:NO2 21℃;-NO-152℃)
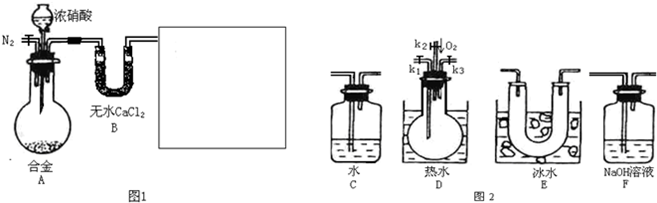
(1)在图2中选择恰当的仪器将图1补充完整,所选择仪器的连接顺序(按左→右连接,填各仪器编号)为
(2)反应前先通入N2目的是
(3)确认气体中含NO的现象是
(4)如果O2过量,则装置F中发生反应的化学方程式为:
(5)反应结束后,关闭开关将烧瓶拿出后的现象为
(6)本题中,浓硝酸(含溶质amol)完全反应,还原产物只有NO和NO2,被还原硝酸的物质的量n的取值范围为
mol<n<
mol
mol<n<
mol.
查看习题详情和答案>>

(1)在图2中选择恰当的仪器将图1补充完整,所选择仪器的连接顺序(按左→右连接,填各仪器编号)为
E→D→F
E→D→F
(2)反应前先通入N2目的是
排尽装置中的空气,防止NO被氧化
排尽装置中的空气,防止NO被氧化
(3)确认气体中含NO的现象是
D中烧瓶内通入O2后,无色气体变成红棕色
D中烧瓶内通入O2后,无色气体变成红棕色
(4)如果O2过量,则装置F中发生反应的化学方程式为:
4NO2+O2+4NaOH=4NaNO3
4NO2+O2+4NaOH=4NaNO3
(5)反应结束后,关闭开关将烧瓶拿出后的现象为
气体颜色变浅
气体颜色变浅
给出合理的解释烧瓶拿出后,气体温度降低,平衡2NO2?N2O4 △H<0向右移动,NO2的浓度减小,气体颜色变浅
烧瓶拿出后,气体温度降低,平衡2NO2?N2O4 △H<0向右移动,NO2的浓度减小,气体颜色变浅
(6)本题中,浓硝酸(含溶质amol)完全反应,还原产物只有NO和NO2,被还原硝酸的物质的量n的取值范围为
| a |
| 4 |
| a |
| 2 |
| a |
| 4 |
| a |
| 2 |