摘要:吸热反应与放热反应 (1)定义:吸热反应: 放热反应: (2)常见的吸热反应和放热反应 吸热反应:大多数的分解反应.Ba(OH)2晶体与NH4Cl固体的反应.碳与水.碳与二氧化碳的反应 放热反应:所有的燃烧反应.大多数的化合反应.酸碱中和反应.金属与酸的反应.铝热反应
网址:http://m.1010jiajiao.com/timu3_id_411932[举报]
在化学反应中,反应物转化成生成物,必然发生能量的变化。
(1)下列说法正确的是 。
| A.化学变化中的能量变化主要由化学键变化引起的 |
| B.放热反应发生时不一定要加热,但吸热反应必须要加热才能发生 |
| C.钢铁的吸氧腐蚀和析氢腐蚀的负极反应都为Fe—2e一= Fe2+ |
| D.CaCO3(s) =" CaO(s)" + CO2(g) ΔH=" +" 178.5 KJ·mol-1的意义是表示1mol CaCO3完全分解生成1mol CaO和1mol CO2气体要放出178.5 KJ的热量 |
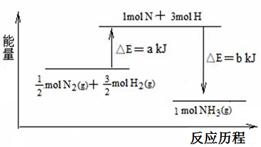
已知:①a=1127;②b=1219
则:1molN2和3molH2参与反应生成2molNH3 (填“吸收”或“放出”)热量 KJ。 查看习题详情和答案>>
在化学反应中,反应物转化成生成物,必然发生能量的变化。
(1)下列说法正确的是 。
(2)101 kPa条件下,氮气和氢气反应生成氨气的能量变化示意图如下:
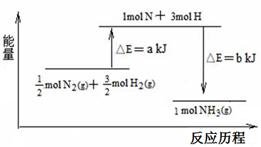
已知:①a=1127;②b=1219
则:1molN2和3molH2参与反应生成2molNH3 (填“吸收”或“放出”)热量 KJ。
(1)下列说法正确的是 。
| A.化学变化中的能量变化主要由化学键变化引起的 |
| B.放热反应发生时不一定要加热,但吸热反应必须要加热才能发生 |
| C.钢铁的吸氧腐蚀和析氢腐蚀的负极反应都为Fe—2e一= Fe2+ |
| D.CaCO3(s) =" CaO(s)" + CO2(g) ΔH=" +" 178.5 KJ·mol-1的意义是表示1mol CaCO3完全分解生成1mol CaO和1mol CO2气体要放出178.5 KJ的热量 |

已知:①a=1127;②b=1219
则:1molN2和3molH2参与反应生成2molNH3 (填“吸收”或“放出”)热量 KJ。
填表:
类型比较 | 放热反应 | 吸热反应 |
定义 |
|
|
形成原因 |
|
|
与化学键强弱关系 |
|
|
表示方法 |
|
|
实例 | H2(g)+Cl2(g) ΔH=-184.6kJ·mol-1 | C(s)+H2O(g) |
在一定条件下, 发生如下反应:
发生如下反应: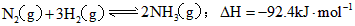 ;
;
(1)该反应中 的含义是(填序号):___________。
的含义是(填序号):___________。
①该反应达到平衡时放出的热量
②该反应达到平衡时吸收的热量
③该条件下,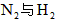 与反应生成
与反应生成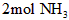 时放出的热量
时放出的热量
④该条件下,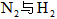 与反应生成
与反应生成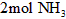 时吸收的热量
时吸收的热量
(2)达到平衡后,在其他条件不变的情况下降低温度,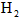 的转化率__________,化学反应速率_____
的转化率__________,化学反应速率_____
(填“增大”、“减小”或“不变”)。
(3)在甲、乙两个容积相等且固定的密闭容器中分别充入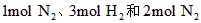 、
、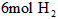 。平衡后,两容器内放出的热量分别记作
。平衡后,两容器内放出的热量分别记作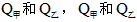 的关系是__________。
的关系是__________。
A.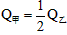 B.
B.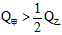 C.
C.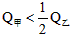 D.无法确定
D.无法确定
查看习题详情和答案>>
 发生如下反应:
发生如下反应: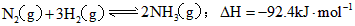 ;
;(1)该反应中
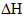 的含义是(填序号):___________。
的含义是(填序号):___________。①该反应达到平衡时放出的热量
②该反应达到平衡时吸收的热量
③该条件下,
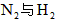 与反应生成
与反应生成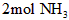 时放出的热量
时放出的热量 ④该条件下,
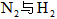 与反应生成
与反应生成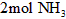 时吸收的热量
时吸收的热量(2)达到平衡后,在其他条件不变的情况下降低温度,
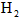 的转化率__________,化学反应速率_____
的转化率__________,化学反应速率_____(填“增大”、“减小”或“不变”)。
(3)在甲、乙两个容积相等且固定的密闭容器中分别充入
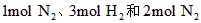 、
、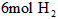 。平衡后,两容器内放出的热量分别记作
。平衡后,两容器内放出的热量分别记作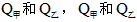 的关系是__________。
的关系是__________。A.
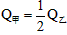 B.
B.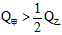 C.
C.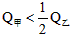 D.无法确定
D.无法确定
乙醇是重要的化工原料和液体燃料,可以利用下列反应制取乙醇:
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)
(1)写出该反应的平衡常数表达式:K=______.
(2)请说明以CO2为原料合成乙醇的优点是______(只要求写出一条).
(3)在一定压强下,测得该反应的实验数据如下表:
①该反应是______反应(填“吸热”或“放热”).
②一定条件下,若提高氢碳比[n(H2)/n(CO2)],则CO2的转化率______;平衡常数K______.(填“增大”、“减小”、或“不变”)
(4)在下图的坐标系中作图说明压强变化对该反应化学平衡的影响,并对图中横坐标、纵坐标的含义作必要的标注.
(5)一种乙醇燃料电池中发生的化学反应为:在酸性溶液中乙醇与氧作用生成水和二氧化碳.该电池的负极反应式为:
______.
(6)25℃、101kPa下,H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ?mol-1、1411.0kJ?mol-1和1366.8kJ?mol-1,请写出由C2H4(g)和H2O(l)反应生成C2H5OH(l)的热化学方程式______.
查看习题详情和答案>>
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)
(1)写出该反应的平衡常数表达式:K=______.
(2)请说明以CO2为原料合成乙醇的优点是______(只要求写出一条).
(3)在一定压强下,测得该反应的实验数据如下表:
| 温度/℃CO2转化率/% n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
②一定条件下,若提高氢碳比[n(H2)/n(CO2)],则CO2的转化率______;平衡常数K______.(填“增大”、“减小”、或“不变”)
(4)在下图的坐标系中作图说明压强变化对该反应化学平衡的影响,并对图中横坐标、纵坐标的含义作必要的标注.

(5)一种乙醇燃料电池中发生的化学反应为:在酸性溶液中乙醇与氧作用生成水和二氧化碳.该电池的负极反应式为:
______.
(6)25℃、101kPa下,H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ?mol-1、1411.0kJ?mol-1和1366.8kJ?mol-1,请写出由C2H4(g)和H2O(l)反应生成C2H5OH(l)的热化学方程式______.
查看习题详情和答案>>