摘要:反应热产生原因 ①.从化学键的断裂E1与E2形成分析: 若E1<E2:反应 能量 若E1>E2:反应 能量 ②.从反应物.生成物所具有的总能量E3.E4分析: 若E3<E4:反应 能量 若E3>E4:反应 能量
网址:http://m.1010jiajiao.com/timu3_id_411931[举报]
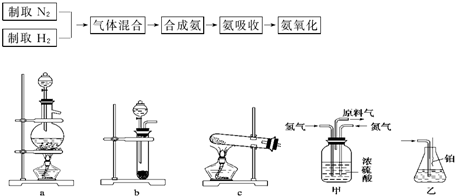
实验室模拟合成氨和氨催化氧化的流程如下:
(1)已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气,该反应中只有氮元素发生变价,写出该反应的化学方程式
从图1中选择制取氮气的合适装置
(2)如图2氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有
(3)如图2用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:
(4)反应结束后锥形瓶内的溶液中含有H+、OH-、
查看习题详情和答案>>

(1)已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气,该反应中只有氮元素发生变价,写出该反应的化学方程式
NaNO2+NH4Cl
N2↑+2H20+NaCl
| ||
NaNO2+NH4Cl
N2↑+2H20+NaCl
.
| ||
从图1中选择制取氮气的合适装置
a
a
.
(2)如图2氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有
控制氢气和氮气的流速
控制氢气和氮气的流速
干燥气体
干燥气体
.(3)如图2用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:
氨的氧化反应是一个放热反应,放出的热使铂丝保持红热
氨的氧化反应是一个放热反应,放出的热使铂丝保持红热
,锥形瓶中还可观察到的现象是:有红棕色气体产生
有红棕色气体产生
.(4)反应结束后锥形瓶内的溶液中含有H+、OH-、
NH4+、NO3-
NH4+、NO3-
离子.实验室模拟合成氨和氨催化氧化的流程如下:?
已知
A.实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气.
B.锥形瓶中的铂丝是氨催化氧化反应的催化剂
(1)从上图中选择制取气体的合适装置:氮气
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还可以
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:
(5)写出乙装置中氨氧化的化学方程式:
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、
查看习题详情和答案>>

已知
A.实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气.
B.锥形瓶中的铂丝是氨催化氧化反应的催化剂
(1)从上图中选择制取气体的合适装置:氮气
a
a
、氢气b
b
.(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还可以
干燥气体
干燥气体
、控制氢气和氮气的流速
控制氢气和氮气的流速
.(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,
不会
不会
(“会”或“不会”)发生倒吸,原因是因为混合气体中含有大量难溶于水的氮气、氢气两种气体
因为混合气体中含有大量难溶于水的氮气、氢气两种气体
.(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:
表明氨的催化氧化反应是一个放热反应
表明氨的催化氧化反应是一个放热反应
,锥形瓶中还可观察到的现象是:有红棕色气体产生?
有红棕色气体产生?
.(5)写出乙装置中氨氧化的化学方程式:
4NH3+5O2
4NO+6H2O?
| ||
| △ |
4NH3+5O2
4NO+6H2O?
.
| ||
| △ |
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、
NH4+
NH4+
、NO3-
NO3-
离子.(2011?静安区模拟)某化工厂联合生产纯碱、镁、阻燃剂.以白云石(CaCO3?MgCO3)为原料冶炼镁:经高温煅烧生成的氧化物在还原炉中经1200℃用硅铁还原生成镁蒸汽(铁化合价不变),镁蒸汽经冷凝为粗镁;同时以海水为原料制碱和制阻燃剂.具体流程如下:
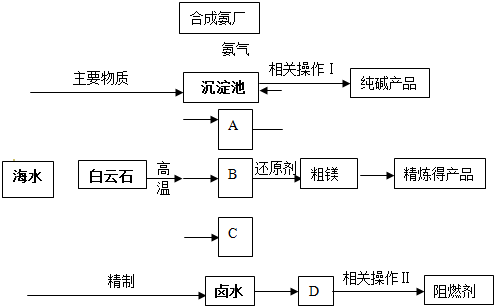
(1)分别写出A、B、C的化学式
(2)硅铁还原生成镁蒸汽时选择低压和1200℃,试分析选择这种反应条件的原因
(3)精制卤水中的MgCl2与适量石灰乳反应生成碱式氯化镁[Mg(OH)Cl]沉淀,此时溶液中主要溶质是(写化学式)
(4)描述流程中相关操作Ⅰ包括过滤、
(5)已知:Mg(OH)2(s)→MgO(s)+H2O(g)-81.5kJ;
Al(OH)3(s)→0.5Al2O3(s)+1.5H2O(g)-87.7kJ
①Mg(OH)2能起阻燃作用,其原因是
②等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好的是
(6)某化工厂利用上图所示流程联合生产纯碱、镁、阻燃剂,试分析该生产的优点
查看习题详情和答案>>

(1)分别写出A、B、C的化学式
CO2
CO2
、MgO
MgO
、CaO
CaO
;沉淀池中反应的化学方程式是CO2+NH3+NaCl+H2O→NaHCO3↓+NH4Cl
CO2+NH3+NaCl+H2O→NaHCO3↓+NH4Cl
.(2)硅铁还原生成镁蒸汽时选择低压和1200℃,试分析选择这种反应条件的原因
低压有利于镁蒸气的生成及分离;1200℃只有镁为气体,从速率和平衡2个角度都有利于镁的生成
低压有利于镁蒸气的生成及分离;1200℃只有镁为气体,从速率和平衡2个角度都有利于镁的生成
.(3)精制卤水中的MgCl2与适量石灰乳反应生成碱式氯化镁[Mg(OH)Cl]沉淀,此时溶液中主要溶质是(写化学式)
CaCl2
CaCl2
.(4)描述流程中相关操作Ⅰ包括过滤、
洗涤
洗涤
、煅烧(或加热)
煅烧(或加热)
.(5)已知:Mg(OH)2(s)→MgO(s)+H2O(g)-81.5kJ;
Al(OH)3(s)→0.5Al2O3(s)+1.5H2O(g)-87.7kJ
①Mg(OH)2能起阻燃作用,其原因是
Mg(OH)2受热分解时吸收大量的热使环境温度下降;同时生成的耐高温、稳定性好的MgO、覆盖在可燃物表面,产生阻燃作用
Mg(OH)2受热分解时吸收大量的热使环境温度下降;同时生成的耐高温、稳定性好的MgO、覆盖在可燃物表面,产生阻燃作用
.②等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好的是
Mg(OH)2
Mg(OH)2
.(6)某化工厂利用上图所示流程联合生产纯碱、镁、阻燃剂,试分析该生产的优点
原料易得价廉、原料利用率高、中间产物能有效地循环利用、产品结构的多样化
原料易得价廉、原料利用率高、中间产物能有效地循环利用、产品结构的多样化
.CH3CH2OH、CH3COOH和NaOH都是中学化学的常用试剂.请回答下列问题:
(1)①乙酸和甲酸甲酯互为同分异构体,但前者的熔点高于后者.原因是
②在油脂的皂化反应中,加入乙醇能加快反应的速率.原因是
③将在空气中灼烧成红热的铜丝伸入无水乙醇中,铜丝立即变为红色.请用化学方程式表示铜丝变红的原因
(2)用0.1mol/LNaOH溶液测定CH3COOH的物质的量浓度,碱式滴定管用标准溶液润洗后即加入标准溶液,经“必要”操作后,进行滴定.
①此处的“必要”操作是指
②选用的指示剂是
③滴点终点时溶液中离子浓度由大到小的顺序是
(3)无水醋酸钠和NaOH固体混合加热时能生成CH4,反应的化学方程式是
(4)乙醇和乙酸在浓硫酸存在下反应生成具有香味的物质,反应的化学方程式是
查看习题详情和答案>>
(1)①乙酸和甲酸甲酯互为同分异构体,但前者的熔点高于后者.原因是
乙酸分子间能形成氢键
乙酸分子间能形成氢键
.②在油脂的皂化反应中,加入乙醇能加快反应的速率.原因是
乙醇易溶于水,油脂易溶于乙醇,从而增大了溶液的接触面
乙醇易溶于水,油脂易溶于乙醇,从而增大了溶液的接触面
.③将在空气中灼烧成红热的铜丝伸入无水乙醇中,铜丝立即变为红色.请用化学方程式表示铜丝变红的原因
CH3CH2OH+CuO
CH3CHO+Cu+H2O
| ||
CH3CH2OH+CuO
CH3CHO+Cu+H2O
.
| ||
(2)用0.1mol/LNaOH溶液测定CH3COOH的物质的量浓度,碱式滴定管用标准溶液润洗后即加入标准溶液,经“必要”操作后,进行滴定.
①此处的“必要”操作是指
除去滴定管尖嘴部分的气泡,使滴定管尖嘴部分充满溶液;调节液面高度到“0”或“0”刻度以下
除去滴定管尖嘴部分的气泡,使滴定管尖嘴部分充满溶液;调节液面高度到“0”或“0”刻度以下
.②选用的指示剂是
酚酞
酚酞
.③滴点终点时溶液中离子浓度由大到小的顺序是
c(Na+)>c(CH3COO-)>c(OH- )>c(H+ )
c(Na+)>c(CH3COO-)>c(OH- )>c(H+ )
.(3)无水醋酸钠和NaOH固体混合加热时能生成CH4,反应的化学方程式是
CH3COONa+NaOH
Na2CO3+CH4↑
| △ |
CH3COONa+NaOH
Na2CO3+CH4↑
,利用此反应制备CH4的装置与制备| △ |
NH3或O2
NH3或O2
相同.(4)乙醇和乙酸在浓硫酸存在下反应生成具有香味的物质,反应的化学方程式是
CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
| 浓H2SO4 |
| △ |
CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
.反应类型是| 浓H2SO4 |
| △ |
酯化反应
酯化反应
,用浓硫酸作催化剂可能造成发生副反应,产生SO2等有毒气体
发生副反应,产生SO2等有毒气体
等问题(答两条即可).
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.我国合成氨工业目前的生产条件为:
催化剂-铁触媒,温度-400~500℃,压强-30~50MPa.
回答下列问题:
(1)合成氨工业中原料气压缩到30~50MPa的原因是 .从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是 .
(2)500℃、50MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x.则K和x的关系满足K= .
(3)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池.请写出该电池的正极反应式 .
(4)已知H2(g)、CO(g)、CH4(g)三种物质的燃烧热分别是-285.8kJ?mol-1、-283.0kJ?mol-1、
-890.3kJ?mol-1,1mol H2O(g)转变为1mol H2O(l)时放出44.0kJ热量.甲烷在高温下与水蒸气反应的化学方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g).那么该反应的反应热△H 0 (填>、=或<).
查看习题详情和答案>>
催化剂-铁触媒,温度-400~500℃,压强-30~50MPa.
回答下列问题:
(1)合成氨工业中原料气压缩到30~50MPa的原因是
(2)500℃、50MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x.则K和x的关系满足K=
(3)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池.请写出该电池的正极反应式
(4)已知H2(g)、CO(g)、CH4(g)三种物质的燃烧热分别是-285.8kJ?mol-1、-283.0kJ?mol-1、
-890.3kJ?mol-1,1mol H2O(g)转变为1mol H2O(l)时放出44.0kJ热量.甲烷在高温下与水蒸气反应的化学方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g).那么该反应的反应热△H