网址:http://m.1010jiajiao.com/timu3_id_411862[举报]
某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是 。
第1组 | 第2组 | 第3组 |
S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2 -76.1℃,SO3 16.8℃;沸点:SO2 -10℃,SO3 45℃)
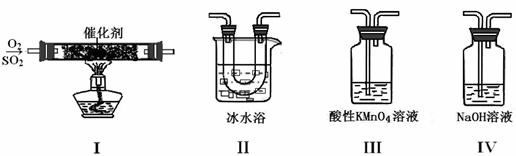 |
①装置I模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按I、II、III、IV的顺序连接装置,装置II的作用是 ;装置III中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是 。
③乙同学按I、II、IV的顺序连接装置,若装置IV中有40 mL 2.5 mol?L-1 NaOH溶液,反应后增重4.8 g,则装置IV中发生反应的化学方程式是 。
查看习题详情和答案>>(1)某同学设计了由乙烯合成合成Y的3条路线(I、II、III)如下图所示.
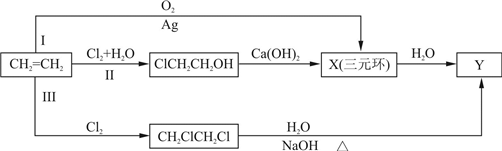
①3条合成路线中,你认为符合“原子经济”要求的合成路线是(填序号“I”、“II”或“III”)
②X的结构简式是
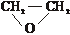
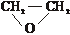
(2)已知Q为乙烯的同系物,以Q和X为原料合成M的方法如下:
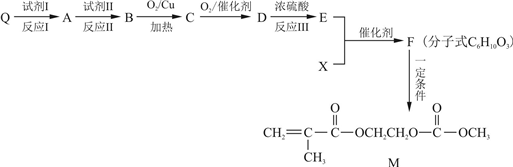
请回答下列问题:
①Q的名称是
②E中含有官能团的名称是
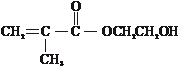
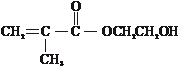
③写出M与足量氢氧化钠溶液反应的化学方程式
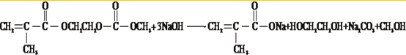
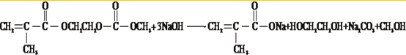
④已知:
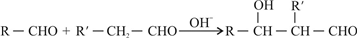 且 C+CH3CHO
且 C+CH3CHO| OH- |
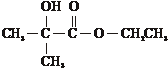 、
、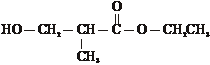
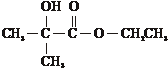 、
、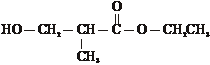
a.与钠反应放出氢气
b.在酸性条件下水解为N和乙醇
c.N中含有支链.
A.实验室中,浓硝酸保存在带橡胶塞的棕色细口试剂并中;
B.制备氢氧化铁胶体时,应向20mL沸水中逐滴滴加1~2mL饱和的FeCl3溶液,并继续加热到液体呈透明的红褐色为止;
C.在石油的分馏实验中,温度计需插入液体中;
D.不慎将浓碱液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液;
E.用酸式滴定管量取20.00mL高锰酸钾酸性溶液;
F.在进行中和热测定时,为保证实验的准确性,我们可以采取以下具体措施:使用碎泡沫以起到隔热保温的作用、使用铜质搅拌棒进行搅拌、取用的碱溶液略过量、进行两到三次实验取平均值.
II.汽车尾气的主要成分为CO2及CO、NOX(NO和NO2)的混合物,其中NO的体积分数占95%以上)等.治理方法之一是在汽车排气管上加装“催化转换器”,利用催化剂使CO和NOX发生反应大部分转化为CO2和N2.某小组在实验室利用下图所示装置模拟处理汽车尾气中CO和NOX的反应并测量反应后混合气体的组成.(已知HCOOH
| ||
| △ |
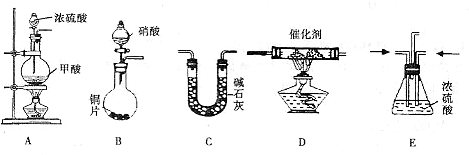
试回答下列问题:
(1)仪器的连接顺序为
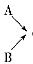 ( )→( )→( )→收集气体
( )→( )→( )→收集气体(2)E装置的作用是
(3)写出D中的NOX与CO反应的化学方程式
| 催化剂 |
| 加热 |
| 催化剂 |
| 加热 |
(4)若B容器中生成的NOX为NO,写出该反应的化学方程式,并标出电子转移的方向和数目
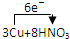 =3Cu(NO3)2+2NO↑+4H2O
=3Cu(NO3)2+2NO↑+4H2O =3Cu(NO3)2+2NO↑+4H2O
=3Cu(NO3)2+2NO↑+4H2O(5)若通入的NOX为NO,C装置增重8.8g,收集到的气体在标准状况下为4.48L(其相对分子质量为28.4).则收集到的气体中NO的物质的量为
(6)选择高效催化剂,将汽车尾气转化为无毒气体,便彻底解决了汽车尾气对环境的影响,这种说法是否正确并阐述理由:
应用化学反应需要研究化学反应的条件、限度和速率。
(1)773 K、固定体积的容器中,反应CO(g)+2H2(g) CH3OH(g)过程中
CH3OH(g)过程中
能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入amol CO、2amol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。

① 若按上述投料比使该反应具有工业应用价值,CO的平衡转化率最小为 ;
② ②在容器容积不变的前提下,欲提高H2的转化率,可采取的措施(答两项即可) 、 ;
③ ③下列与催化剂有关的说法中,正确的是 (填字母序号)。
④
a.使用催化剂,使反应 CO(g)+2H2(g) CH3OH(g) ΔH>-91
kJ·mol-1
CH3OH(g) ΔH>-91
kJ·mol-1
⑤ b.使用催化剂,能够提高反应物转化率
c.使用催化剂,不能改变反应的平衡常数K
(2)高铁酸盐在能源环保领域有广泛用途。我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的方案,装置如下图I所示。
①Fe电极作 极(填“阴”或“阳”);
②Ni电极的电极反应式为: 。
(3)欲用下图II装置通过测定气体生成量测算硝酸被还原的速率,当反应物的浓度、 用量及其他影响速率的条件确定之后,可以通过测定
用量及其他影响速率的条件确定之后,可以通过测定
推算反应速率。

查看习题详情和答案>>