网址:http://m.1010jiajiao.com/timu3_id_411298[举报]
(1)HClO不稳定,见光易分解生成HCl和O2,请设计实验证明有O2生成.
(2)氯气能使湿润的红色布条褪色.对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能.请你设计实验,得出正确结论.
| 提出问题 | 收集资料 | 提出假设 | 验证假设 | 得出结论 |
| 氯水中何种物质能使湿润的红色布条褪色 | ①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 |
① ② ③ ④H2O使布条褪色 |
实验①:把红色干布条放入充满氯气的集气瓶中,布条不褪色 实验②: 实验③: 实验④:把红色布条放在水里布条不褪色 |
H2CO3?HCO3-+H+ Ka1(H2CO3)=4.45×10-7
HCO3-?CO32-+H+ Ka2(HCO3-)=5.61×10-11
HClO?H++ClO- Ka(HClO)=2.95×10-8
请依据以上电离平衡常数,写出在下列条件下所发生反应的离子方程式:
①将少量的氯气通入到过量的碳酸钠溶液中;
②氯气和碳酸钠按照1:1的比例恰好反应;
③将过量的氯气通入到少量的碳酸钠溶液中.
新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)氯气能使湿润的红色布条褪色。使其褪色的微粒的化学式是______
(2)将氯水在光照上一段时间,溶液颜色逐渐变浅,其有关反应的化学方程式为:
、
(3)平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。
H2CO3
+H+ Ka1(H2CO3)=4.45×10—7
+H+ Ka2(HCO3-)=5.61×10-11
HclO H++
Ka(HClO)=2.95×10-8
请依据以上电离平衡常数,请写出将少量的氯气通入到过量的碳酸钠溶液中所发生反应的离子方程式:
(4)饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。
实验一、定性研究:
① 在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,
有少量气泡产生,溶液浅黄绿色褪去;
② 过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③ 为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。
请回答:
① 反应后所得的溶液漂白性增强的原因是______ ___________ ____
②依据上述实验可推知:②的滤液中的溶质除CaCl2、HClO外,还含有______ _ 。
实验二、定量研究:
在圆底烧瓶底部,有一用塑料网包住的过量块状 碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加(不考虑HClO的分解)。
请回答:
③ 写出仪器(1)与仪器(3)的名称
(1) (3)
④ 为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是 。
⑤ 如何准确读出量筒中气体的体积
a________ _
b 上下移动量筒至量筒内液面与水槽液面相平
c
查看习题详情和答案>>
Ⅰ、常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HA的浓度/(mol/L) |
NaOH的浓度/(mol/L) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
c |
0.2 |
pH=7 |
|
丙 |
0.2 |
0.1 |
pH>7 |
|
丁 |
0.1 |
0.1 |
pH=9 |
请回答:
(1)不考虑其它的实验结果,单从甲组情况分析,若a 7(填“>”、“<”或“=”)则HA为弱酸;
(2)不考虑其它组的实验结果,仅从乙组情况分析,则下列叙述一定错误的是
A.酸溶液的物质的量浓度大于碱溶液
B.酸溶液中H+的浓度大于碱溶液中OH-的浓度
C.酸溶液的物质的量浓度小于碱溶液
D.酸溶液中H+的浓度小于碱溶液中OH-的浓度
E.两种溶液的物质的量浓度相等
(3)从丙组实验结果分析,HA是 酸(填“强”或“弱”)。 若此时10mL0.5mol/LNaA溶液与6mL1mol/L盐酸混合后,溶液中除OH—外的各离子浓度由大到小顺序为 ;
(4)丁组实验所得混合溶液中由水电离出来的c(OH—)= mol/L。
(5)假设HA是一元弱酸,而难溶物CaA2在水中存在溶解平衡:CaA2(s)  Ca2++2A-
Ca2++2A-
△H>0,一定温度下CaA2饱和溶液中Ksp=c(Ca2+)c2(A2-)为一常数。
①温度升高时,Ksp (填“增大”、“减小”或“不变”)。
②测得25℃时,CaA2的Ksp为4.0×10-11,常温下将10g CaA2固体投入100mLCaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1mol/L,则溶液中c(A2-)= 。
Ⅱ、平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。


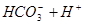









请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
(1)将少量的氯气通入到过量的碳酸钠溶液中___ _____________;
(2)氯气和碳酸钠按照1︰1的物质的量之比恰好反应_______________________________;
查看习题详情和答案>>
Ⅰ、常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA的浓度/(mol/L) | NaOH的浓度/(mol/L) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
请回答:
(1)不考虑其它的实验结果,单从甲组情况分析,若a 7(填“>”、“<”或“=”)则HA为弱酸;
(2)不考虑其它组的实验结果,仅从乙组情况分析,则下列叙述一定错误的是
A.酸溶液的物质的量浓度大于碱溶液
B.酸溶液中H+的浓度大于碱溶液中OH-的浓度
C.酸溶液的物质的量浓度小于碱溶液
D.酸溶液中H+的浓度小于碱溶液中OH-的浓度
E.两种溶液的物质的量浓度相等
(3)从丙组实验结果分析,HA是 酸(填“强”或“弱”)。 若此时10mL0.5mol/LNaA溶液与6mL1mol/L盐酸混合后,溶液中除OH—外的各离子浓度由大到小顺序为 ;
(4)丁组实验所得混合溶液中由水电离出来的c(OH—)= mol/L。
(5)假设HA是一元弱酸,而难溶物CaA2在水中存在溶解平衡:CaA2(s) ![]() Ca2++2A-
Ca2++2A-
△H>0,一定温度下CaA2饱和溶液中Ksp=c(Ca2+)c2(A2-)为一常数。
①温度升高时,Ksp (填“增大”、“减小”或“不变”)。
②测得25℃时,CaA2的Ksp为4.0×10-11,常温下将10g CaA2固体投入100mLCaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1mol/L,则溶液中c(A2-)= 。
Ⅱ、平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
(1)将少量的氯气通入到过量的碳酸钠溶液中___ _____________;
(2)氯气和碳酸钠按照1︰1的物质的量之比恰好反应_______________________________;
查看习题详情和答案>>
新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)氯气能使湿润的红色布条褪色。使其褪色的微粒的化学式是______
(2)将氯水在光照上一段时间,溶液颜色逐渐变浅,其有关反应的化学方程式为:
、
(3)平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。
H2CO3 
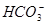 +
H+
Ka1(H2CO3)=4.45×10—7
+
H+
Ka1(H2CO3)=4.45×10—7
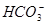

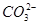 +H+
Ka2(HCO3-)=5.61×10-11
+H+
Ka2(HCO3-)=5.61×10-11
HclO  H++
H++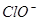 Ka(HClO)=2.95×10-8
Ka(HClO)=2.95×10-8
请依据以上电离平衡常数,请写出将少量的氯气通入到过量的碳酸钠溶液中所发生反应的离子方程式:
(4)饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。

实验一、定性研究:
① 在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,
有少量气泡产生,溶液浅黄绿色褪去;
② 过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③ 为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。
请回答:
① 反应后所得的溶液漂白性增强的原因是______ ___________ ____
②依据上述实验可推知:②的滤液中的溶质除CaCl2、HClO外,还含有______ _ 。
实验二、定量研究:
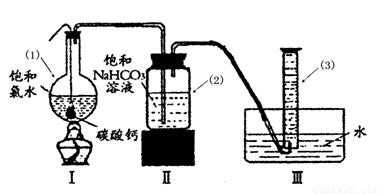
在圆底烧瓶底部,有一用塑料网包住的过量块状 碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加(不考虑HClO的分解)。
请回答:
③ 写出仪器(1)与仪器(3)的名称
(1) (3)
④ 为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是 。
⑤ 如何准确读出量筒中气体的体积
a________ _
b 上下移动量筒至量筒内液面与水槽液面相平
c
查看习题详情和答案>>