摘要:16.工业上处理含Cr2O72-的酸性工业废水用以下方法:①往工业废水中加入适量的NaCl.搅拌均匀,②用Fe为电极进行电解.经过一段时间最后有Cr(OH)3和Fe(OH)3沉淀产生,③过滤回收沉淀.废水达到排放标准.试回答: (1)电解时的电极反应:阳极 . 阴极 . (2)Cr2O72-转变成Cr3+的离子反应方程式: . (3)能否用Cu电极来代替Fe电极? .理由是 .
网址:http://m.1010jiajiao.com/timu3_id_411220[举报]
含Cr2O72-的酸性工亚废水会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转变为Cr(OH)3除去。工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓人空气。结果溶液的pH不断升高,溶液由酸性转为碱性。在以上处理过程中,溶液pH升高的原因是( )
A. 电解时废水体积减小
B. 鼓人空气使溶液中OH-浓度增大
C. 电解时H+在阴极被还原
D. Cr2O72-被还原为Cr3+时消耗了H+
查看习题详情和答案>>
含Cr2O72-的酸性工亚废水会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转变为Cr(OH)3除去。工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓人空气。结果溶液的pH不断升高,溶液由酸性转为碱性。在以上处理过程中,溶液pH升高的原因是( )
A. 电解时废水体积减小
B. 鼓人空气使溶液中OH-浓度增大
C. 电解时H+在阴极被还原
D. Cr2O72-被还原为Cr3+时消耗了H+
查看习题详情和答案>>
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
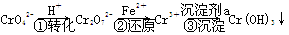
其中第①步中存在平衡:2CrO42- (黄色)+2H+??Cr2O72- (橙色)+H2O。下列有关说法正确的是( )
A.第①步当2v(Cr2O72-)=v(CrO42-)时,达到了平衡状态
B.对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO42-的生成
C.第②步中,还原0.1 mol Cr2O72-需要45.6 g FeSO4
D.第③步沉淀剂a可以使用NaOH等碱性物质
查看习题详情和答案>>
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:

其中第①步中存在平衡:2CrO42- (黄色)+2H+??Cr2O72- (橙色)+H2O。下列有关说法正确的是( )

其中第①步中存在平衡:2CrO42- (黄色)+2H+??Cr2O72- (橙色)+H2O。下列有关说法正确的是( )
| A.第①步当2v(Cr2O72-)=v(CrO42-)时,达到了平衡状态 |
| B.对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO42-的生成 |
| C.第②步中,还原0.1 mol Cr2O72-需要45.6 g FeSO4 |
| D.第③步沉淀剂a可以使用NaOH等碱性物质 |
工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法。
(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。
①请用离子方程式说明上述除杂的原理 。
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是 (填序号)
③若将足量SO2气体通入0.2 mol·L-1的NaOH溶液,所得溶液呈酸性,则溶液中离子浓度由大到小的顺序为 。
(2)采用电解法处理含有Cr2O72-的酸性废水,在废水中加入适量NaCl,用铁电极电解一段时间后,有Cr(OH)3和Fe(OH)3沉淀生成,从而降低废水中铬元素的含量。若阳极用石墨电极则不能产生Cr(OH)3沉淀,用必要的化学语言说明原因___________________。
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池。如图是该燃料电池示意图,产生的X气体可直接排放到大气中。a电极作 极(填“正”“负”“阴”或“阳”),其电极反应式为 ;T℃下,某研究员测定NH3·H2O的电离常数为1.8×10-5,NH4+的水解平衡常数为1.5×10-8(水解平衡也是一种化学平衡,其平衡常数即水解常数),则该温度下水的离子积常数为 ,请判断T 25℃(填“>”“<”“=”)。

(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。
①请用离子方程式说明上述除杂的原理 。
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是 (填序号)
| A.Ba(NO3)2 | B.BaCl2 | C.Ba(OH)2 | D.溶有NH3的BaCl2溶液 |
(2)采用电解法处理含有Cr2O72-的酸性废水,在废水中加入适量NaCl,用铁电极电解一段时间后,有Cr(OH)3和Fe(OH)3沉淀生成,从而降低废水中铬元素的含量。若阳极用石墨电极则不能产生Cr(OH)3沉淀,用必要的化学语言说明原因___________________。
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池。如图是该燃料电池示意图,产生的X气体可直接排放到大气中。a电极作 极(填“正”“负”“阴”或“阳”),其电极反应式为 ;T℃下,某研究员测定NH3·H2O的电离常数为1.8×10-5,NH4+的水解平衡常数为1.5×10-8(水解平衡也是一种化学平衡,其平衡常数即水解常数),则该温度下水的离子积常数为 ,请判断T 25℃(填“>”“<”“=”)。
