摘要:25.某碱金属元素的两种碳酸盐组成的混合物样品6.14 g.加水溶解后.取所得溶液的十分之一.向其中缓缓加入一定浓度的稀盐酸.并同时记录放出CO2的体积和消耗稀盐酸的体积.得到下图所示的曲线. 试计算: (1)混合物中碳元素的质量分数. (2)确定这两种碳酸盐的化学式. (3)所滴加盐酸的物质的量浓度.
网址:http://m.1010jiajiao.com/timu3_id_411198[举报]
(2013?金华模拟)某物质M具有热导率高、高温下电绝缘性好、高温下材料强度大、无毒等优异性能.经检测,M中只含有两种短周期元素.现取82gM溶于适量的NaOH溶液中恰好反应,得到无色溶液A和44.8L气体B(气体体积为标准状况下),该气体能使红色石蕊试纸变蓝.往反应后的溶液中逐滴加入盐酸,可观察到溶液先变浑浊后变澄清.
物质B有如下转化关系:B
C
D
EE是一种强酸.将c和D的混合物溶解在接近零度的水中,即可得到一种弱酸F的水溶液.请回答下列问题:
(1)物质M的化学式为
(2)无色溶液A呈碱性,其原因是
(3)弱酸F是一种比醋酸酸性稍强的弱酸,很不稳定,通常在室温下易分解.要制得F溶液,可以往冷冻的其钠盐浓溶液中加入或通入某种物质,下列物质不适合使用的是
a.盐酸 b.二氧化碳 c.稀硫酸 d.二氧化硫
(4)工业碱性废水中若含有NO-2,可用铝粉除去.已知此反应体系中检测到B气体.写出上述反应的离子方程式
(5)现发现一种活性很强的化合物G,其组成为NH5,G遇水能产生两种气体,其中一种气体为B,则物质G的电子式为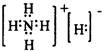
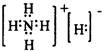 .
.
查看习题详情和答案>>
物质B有如下转化关系:B
| X |
| X |
| H2O |
(1)物质M的化学式为
AlN
AlN
,属于原子
原子
晶体(填“分子”、“离子”、“原子”等).(2)无色溶液A呈碱性,其原因是
AlO2-+2H2O=Al(OH)3+OH-
AlO2-+2H2O=Al(OH)3+OH-
(用离子方程式表示).(3)弱酸F是一种比醋酸酸性稍强的弱酸,很不稳定,通常在室温下易分解.要制得F溶液,可以往冷冻的其钠盐浓溶液中加入或通入某种物质,下列物质不适合使用的是
bd
bd
(填序号).a.盐酸 b.二氧化碳 c.稀硫酸 d.二氧化硫
(4)工业碱性废水中若含有NO-2,可用铝粉除去.已知此反应体系中检测到B气体.写出上述反应的离子方程式
2Al+NO2-+OH-+H2O=2AlO2-+NH3↑
2Al+NO2-+OH-+H2O=2AlO2-+NH3↑
.若改用电解法将废水中NO-2转换为N2除去,N2将在阴极
阴极
(填“阴极”或“阳极”)生成,电极反应为2NO2-+6e-+4H2O=N2+8OH-
2NO2-+6e-+4H2O=N2+8OH-
.(5)现发现一种活性很强的化合物G,其组成为NH5,G遇水能产生两种气体,其中一种气体为B,则物质G的电子式为
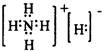
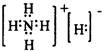
现有某种碱金属元素组成的两种碳酸盐(正盐和酸式盐)的混合物4.86 g ,加水溶解后,取所得溶液的 ,向其中逐滴加入一定浓度的稀盐酸,并同时记录放出CO2的体积(标准状况)和消耗盐酸的体积,得到如图所示的曲线。
,向其中逐滴加入一定浓度的稀盐酸,并同时记录放出CO2的体积(标准状况)和消耗盐酸的体积,得到如图所示的曲线。

请计算:
(1)原混合物中碳元素的质量分数。
(2)确定此两种碳酸盐的化学式。
(3)所滴加盐酸的物质的量浓度。
查看习题详情和答案>>现有某种碱金属元素组成的两种碳酸盐(正盐和酸式盐)的混合物4.86 g,加水溶解后,取所得溶液的![]() ,向其中逐滴加入一定浓度的稀盐酸,并同时记录放出CO2的体积(标准状况)和消耗盐酸的体积,得到如图所示的曲线.
,向其中逐滴加入一定浓度的稀盐酸,并同时记录放出CO2的体积(标准状况)和消耗盐酸的体积,得到如图所示的曲线.

请计算:(1)原混合物中碳元素的质量分数.
(2)确定此两种碳酸盐的化学式.
(3)所滴加盐酸的物质的量浓度.

