网址:http://m.1010jiajiao.com/timu3_id_411193[举报]
某课外兴趣小组对双氧水(H2O2水溶液)做了如下实验探究。
(1)将质量相同但聚集状态不同的MnO2分别加入 5 mL 5%的双氧水中,并用带火星的木条试之。测定结果如下:

①写出H2O2反应的化学方程式:__________________;②实验结果说明催化剂作用的大小与__________有关。
(2)取三份含有等量H2O2、但质量分数不同的双氧水,分别向其中加入 1 g MnO2粉末。测定结果如下,请简要说明:

①反应完成所需的时间不同的原因:________________;②反应后液体温度不同的原因:____________________;
③收集到气体体积不同的原因:______________。
(3)向含有酚酞的NaOH稀溶液中,逐滴滴入10%的双氧水,红色褪去。
①已知双氧水显弱酸性,试写出H2O2的电离方程式:____________________________;
②小组讨论红色褪去的原因时,甲同学认为是双氧水显酸性所致;乙同学认为是双氧水有较强氧化性所致。请你设计一个简单实验来说明是甲对还是乙对(简要文字说明):________________________________________________。
查看习题详情和答案>>某课外兴趣小组对双氧水
(H2O2水溶液)做了如下实验探究.(1)将质量相同但聚集状态不同的MnO2分别加入5 mL 5%的双氧水中,并用带火星的木条试之.测定结果如下:

①写出
H2O2反应的化学方程式:________;②实验结果说明催化剂作用的大小与
________有关.(2)取三份含有等量H2O2,但质量分数不同的双氧水,分别向其中加入1 g MnO2粉末.测定结果如下,请简要说明:
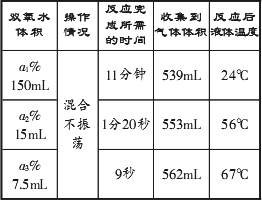
①反应完成所需的时间不同的原因:
________;②反应后液体温度不同的原因:
________;③收集到气体体积不同的原因:
________.(14分)某课外兴趣小组对双氧水(H2O2水溶液)做了如下实验探究。
(1)将质量相同但聚集状态不同的MnO2分别加入5mL 5%的双氧水中,并用带火星的木条试之。测定结果如下:
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,使木条复燃 | 3.5分钟 |
| 块状 | | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
②实验结果说明催化剂作用的大小与 有关。
(2)取三份含有等量H2O2,但质量分数不同的双氧水,分别向其中加入1克MnO2粉末。测定结果如下:
| 双氧水体积 | 操作情况 | 反应完成所需的时间 | 收集到气体体积 | 反应后液体温度 |
| a1%的150mL | | 11分钟 | 539mL | 24℃ |
| a2%的15mL | 混合不振荡 | 1分20秒 | 553mL | 56℃ |
| a3%的7.5mL | | 9秒 | 562mL | 67℃ |
①反应完成所需的时间不同的原因 。
②反应后液体温度不同的原因 。
③收集到气体体积不同的原因 。
(3)向含有酚酞的NaOH稀溶液中,逐滴滴入10%的双氧水,红色褪去。
①已知双氧水显弱酸性,试写出H2O2的电离方程式: 。
②小组讨论红色褪去的原因时,甲同学认为是双氧水显酸性所致;乙同学认为是双氧水有较强氧化性所致。请你设计一个简单实验来说明是甲对还是乙对。(简要文字说明) 查看习题详情和答案>>
(1)将质量相同但聚集状态不同的MnO2分别加入5mL 5%的双氧水中,并用带火星的木条试之。测定结果如下:
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,使木条复燃 | 3.5分钟 |
| 块状 | | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
②实验结果说明催化剂作用的大小与 有关。
(2)取三份含有等量H2O2,但质量分数不同的双氧水,分别向其中加入1克MnO2粉末。测定结果如下:
| 双氧水体积 | 操作情况 | 反应完成所需的时间 | 收集到气体体积 | 反应后液体温度 |
| a1%的150mL | | 11分钟 | 539mL | 24℃ |
| a2%的15mL | 混合不振荡 | 1分20秒 | 553mL | 56℃ |
| a3%的7.5mL | | 9秒 | 562mL | 67℃ |
①反应完成所需的时间不同的原因 。
②反应后液体温度不同的原因 。
③收集到气体体积不同的原因 。
(3)向含有酚酞的NaOH稀溶液中,逐滴滴入10%的双氧水,红色褪去。
①已知双氧水显弱酸性,试写出H2O2的电离方程式: 。
②小组讨论红色褪去的原因时,甲同学认为是双氧水显酸性所致;乙同学认为是双氧水有较强氧化性所致。请你设计一个简单实验来说明是甲对还是乙对。(简要文字说明)

(1)已知,I2遇淀粉显蓝色。甲同学从下列试剂中选择了一种检验试剂,成功地检测到了双氧水的存在,该试剂是______。
A.淀粉溶液 B.氯化钠溶液
C.氢氧化钠溶液 D.淀粉KI酸性溶液
甲同学检验时证明有双氧水产生的现象是________________;冰块的作用是____________。
(2)乙同学用较稀的酸性高锰酸钾溶液作为检验试剂,实验时观察到酸性高锰酸钾溶液褪色(生成Mn2+),由此也证明了氢气燃烧有双氧水生成,写出该反应的离子方程式:______________。
(3)丙同学对乙同学的检验方案提出质疑:若锌粒中杂质与稀硫酸反应有少量H2S、SO2等气体生成,也会使酸性高锰酸钾溶液褪色,从而导致错误的判断。为消除丙同学的疑虑,请你提出对上述实验装置的改进建议: ___________________。
(4)除上述检验双氧水存在的方案外,请你再列举简便可行的验证方案。 查看习题详情和答案>>