摘要:9. 对反应N2+3H22NH3.下列变化可增大活化分子百分数而使反应速率加快的有( ) ①增大压强 ②升高温度 ③增大H2浓度 ④使用催化剂 A.①③④ B.①②④ C.②③ D.②④
网址:http://m.1010jiajiao.com/timu3_id_410927[举报]
 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
写出氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:
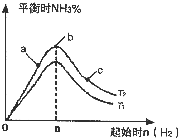
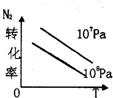
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对反应N2(g)+3H2(g)?2NH3(g)的影响.实验结果如图所示:(图中T表示温度,n表示物质的量)
①图象中T2和T1的关系是:T2
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是
(3)在一定温度和催化剂下,将3.2mol H2和1.2molN2混合于一个容积为2L的密闭容器中发生反应,在2min末时反应恰好达平衡,此时生成了0.8mol NH3.计算:(写出计算过程,结果保留小数点后一位)
①2min内以H2表示的化学反应速率;
②该条件下的平衡常数?
 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
完成氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:
4NH3(g)+5O2(g)═4NO(g)+6H2O(g);△H=
-905
-905
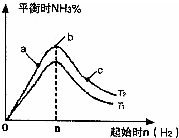
kJ/mol(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对反应N2(g)+3H2(g)?2NH3(g)的影响.实验结果如图所示:(图中T表示温度,n表示物质的量)
①图象中T1和T2的关系是:T1
<
<
T2(填“高于”“低于”“等于”“无法确定”)②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最低的是
c
c
(填字母).(3)在一定温度和催化剂下,将3.2mol H2和1.2molN2混合于一个容积为2L的密闭容器中发生反应,在2min末时反应恰好达平衡,此时生成了0.8mol NH3.计算该条件下的平衡常数.(写出计算过程,结果保留小数点后一位)
 工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等.
工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等.(1)火箭常用N2H4作燃料,N2O4作氧化剂.已知:
N2(g)+2O2(g)═2NO2(g)△H=67.7kJ?mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ?mol-1
NO2(g)?
| 1 | 2 |
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
(2)联氨--空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的氢氨化钾溶液.该电池放电时,正极的电极反应式为
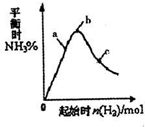
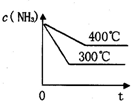
(3)在300℃时,改变起始反应物中氢气的物质的量对反应N2(g)+2H2(g)?2NH3(g)△H<0的影响如图所示.
①请在图中画出400℃时对应的图象.
②在a、b、c三点中,H2的转化率最高的是
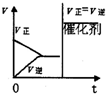
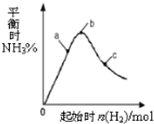 在300℃时,改变起始反应物中n(H2)对反应N2(g)+3H2(g)?2NH3(g)+Q(Q>0)的影响如图所示.下列说法正确的是( )
在300℃时,改变起始反应物中n(H2)对反应N2(g)+3H2(g)?2NH3(g)+Q(Q>0)的影响如图所示.下列说法正确的是( )