摘要:计算题: 配制1mol·L-1H2SO4溶液200mL需溶质质量分数为98%(ρ=1.84g·/cm3)的浓H2SO4多少毫升?
网址:http://m.1010jiajiao.com/timu3_id_410604[举报]
计算题:在密闭容器中进行的如下反应:2SO2(g)+O2(g)?2SO3(g).SO2的起始浓度是0.4mol/l,O2的起始浓度是1mol/l,当SO2的转化率为50%时,反应达到平衡状态.
(1)求SO2的转化浓度
(2)求反应的平衡常数
(3)求O2的转化率.
查看习题详情和答案>>
(1)求SO2的转化浓度
(2)求反应的平衡常数
(3)求O2的转化率.
计算题:
在50mLamol?L-1的硝酸溶液中,加入6.4gCu,全部溶解,假设硝酸的还原产物只有NO和NO2,将反应后溶液用蒸馏水稀释至100mL时测得c(NO3-)=3mol?L-1.
(1)则稀释后的溶液c(H+)=
(2)若a=9,则生成的气体中NO的物质的量为
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO+NO2+2NaOH═2NaNO2+H2O
2NO2+2NaOH═NaNO2+NaNO3+H2O
若将上述的NO和NO2的混合气体通入1mol?L-1的NaOH溶液恰好被吸收,NaOH溶液的体积为
查看习题详情和答案>>
在50mLamol?L-1的硝酸溶液中,加入6.4gCu,全部溶解,假设硝酸的还原产物只有NO和NO2,将反应后溶液用蒸馏水稀释至100mL时测得c(NO3-)=3mol?L-1.
(1)则稀释后的溶液c(H+)=
1
1
mol?L-1.(2)若a=9,则生成的气体中NO的物质的量为
0.025
0.025
mol,NO2的物质的量为0.125
0.125
mol.(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO+NO2+2NaOH═2NaNO2+H2O
2NO2+2NaOH═NaNO2+NaNO3+H2O
若将上述的NO和NO2的混合气体通入1mol?L-1的NaOH溶液恰好被吸收,NaOH溶液的体积为
150
150
mL.化学是一门以实验为基础的自然科学,正确搭配、选择、识别各种实验装置,是基本的化学素养之一.请按要求完成下列四小题.
(1)一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验.某研究性学习小组在实验室中配制1mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液.下列有关说法中正确的是
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B.如果实验中需用60mL 的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大;
E.配制溶液时,若在最后一次读数时俯视读数,则导致实验结果偏大.
F.中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏大.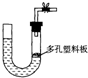
(2)右图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是
A.大理石和稀硫酸制取二氧化碳
B.锌粒和稀硫酸制氢气
C.浓硫酸和亚硫酸钠制取二氧化硫
D.电石和水制取乙炔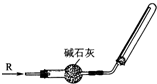
(3)实验室可用右下图所示装置干燥收集某气体R,则R可能是
A.S02 B.NH3
C.NO D.Cl2
(4)某同学如右图所示装置进行实验,出现小气球鼓起来的现象,则使用的固体和液体试剂可能是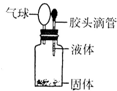
A.铜与浓硫酸 B.铁与浓硫酸
C.铝和氢氧化钠溶液 D.二氧化锰和浓盐酸
(5)指出下面3个实验中各存在的一个错误
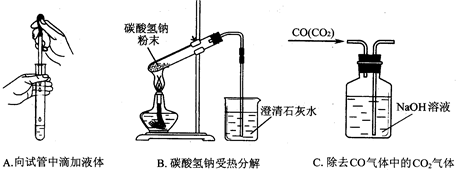
A
查看习题详情和答案>>
(1)一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验.某研究性学习小组在实验室中配制1mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液.下列有关说法中正确的是
ABD
ABD
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B.如果实验中需用60mL 的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大;
E.配制溶液时,若在最后一次读数时俯视读数,则导致实验结果偏大.
F.中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏大.

(2)右图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是
B
B
A.大理石和稀硫酸制取二氧化碳
B.锌粒和稀硫酸制氢气
C.浓硫酸和亚硫酸钠制取二氧化硫
D.电石和水制取乙炔

(3)实验室可用右下图所示装置干燥收集某气体R,则R可能是
B
B
A.S02 B.NH3
C.NO D.Cl2
(4)某同学如右图所示装置进行实验,出现小气球鼓起来的现象,则使用的固体和液体试剂可能是
C
C

A.铜与浓硫酸 B.铁与浓硫酸
C.铝和氢氧化钠溶液 D.二氧化锰和浓盐酸
(5)指出下面3个实验中各存在的一个错误
滴管口伸入试管中;试管口向上;混合气体从短导管进入洗气瓶.
滴管口伸入试管中;试管口向上;混合气体从短导管进入洗气瓶.

A
滴管口伸入试管中
滴管口伸入试管中
;B试管口向上
试管口向上
; C混合气体从短导管进入洗气瓶
混合气体从短导管进入洗气瓶
.(2009?肇庆一模)硫酸的消费量常被作为国家工业发展水平的一种标志.工业合成硫酸最重要一步:2SO2(g)+O2 (g)?2SO3(g)△H<0.在一定条件下,将2mol SO2(g) 和1mol O2 (g) 充入2L密闭容器中,反应从起始到平衡后压强变为原来的11/15.回答下列问题:
(1)下表为2SO2(g)+O2 (g)?2SO3(g)反应的温度和压强对SO2转化率的影响:
你认为最好选择的压强是
(2)请计算题干条件下SO2的平衡转化率及SO3(g)?SO2(g)+1/2O2 (g)的平衡常数,写出计算过程(最后一步不必算出精确数值):
查看习题详情和答案>>
(1)下表为2SO2(g)+O2 (g)?2SO3(g)反应的温度和压强对SO2转化率的影响:
| 压强/MPa 温度/℃ |
0.1 | 0.5 | 1 | 10 | 常压为1.01x105 =101kPa =0.1MPa |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% | |
| 500 | 93.5% | 96.9% | 97.8% | 98.7% | |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
0.1MPa
0.1MPa
理由是:常压时SO2的转化率已经很高,若加压对设备要求高、增大投资和能耗
常压时SO2的转化率已经很高,若加压对设备要求高、增大投资和能耗
.(2)请计算题干条件下SO2的平衡转化率及SO3(g)?SO2(g)+1/2O2 (g)的平衡常数,写出计算过程(最后一步不必算出精确数值):
 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况,回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况,回答下列问题:(1)如图所示的仪器中配制溶液肯定不需要的是
AC
AC
(填序号),仪器C的名称是分液漏斗
分液漏斗
,本实验所需玻璃仪器E规格为500
500
mL.(2)下列操作中,容量瓶所不具备的功能有
BCD
BCD
(填序号).A.配制一定体积准确浓度的标准溶液 B.长期贮存溶液
C.用来加热溶解固体溶质 D.量取一定体积的液体
(3)在配制NaOH溶液实验中,其他操作均正确.若定容时仰视刻度线,则所配制溶液浓度
小于
小于
0.1mol/L(填“大于”“等于”或“小于”,下同).若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度大于
大于
0.1mol/L.(4)根据计算得知,配制所需NaOH固体质量
2.0
2.0
g.配制所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为13.6
13.6
mL(计算结果保留一位小数).如果实验室有10mL、25mL、50mL量筒,应选用25
25
mL规格的量筒最好.