摘要:26.某种粗盐中含有泥沙.Ca2+.Mg2+.Fe3+.SO42-等杂质.某同学在实验室中设计了用这种粗盐制备糖盐的方案如下: 请回答以下问题: (1)为相应操作选择所需仪器:操作I ,操作IV . A.烧杯 B.托盘天平 C.电子天平 D.试管 E.玻璃棒 F.分液漏斗 G.漏斗 H.泥三角 I.酒精灯 J.蒸发皿 (2)操作III中常用Na2CO3.BaCl2(aq)作为除杂试剂.则加入除杂试剂 的顺序为: NaOH (aq)→ → . 写除去Fe3+的离子方程式: . (3)操作III中.判断加入BaCl2已过量的方法是: . (4)操作V应选择的酸是: .若将操作V与操作IV的先后顺序对调.将 会对实验结果产生的影响是: .高考资源 (5)操作VI是: .(选择合理操作的名称.用标号字母按操作先后顺序填写). 蒸发.浓缩 冷却.结晶27. 有一瓶澄清溶液.其中可能含有Na+.K+.NH4+.Mg2+.Ba2+.Al3+.Fe3+.Cl-.I-.NO3-.CO32-.SO42-.取该溶液进行以下实验:高考资源 (1)取溶液用pH试纸检验.溶液显强酸性. (2)取出部分溶液.加入少量CCl4及数滴新制氯水.经振荡后CCl4层呈紫色. (3)另取部分溶液逐滴加入氢氧化钠溶液.使溶液从酸性逐渐变为碱性.在滴加过程中和滴定完毕后.溶液均无沉淀生成. 中碱性溶液加碳酸钠溶液.有白色沉淀生成.高考资源 中的碱性溶液加热.有气体放出.该气体能使湿润的红色石蕊试纸变蓝色. 根据上述实验事实确定.该溶液中肯定存在离子是 ,尚不能确 定是否存在的离子是 .高考资源
网址:http://m.1010jiajiao.com/timu3_id_410339[举报]
某种粗盐中含有泥沙、Ca2+、Mg2+、Fe3+、SO等杂质。某同学在实验室中设计了用这种粗盐制备精盐的方案如下(用于沉淀的试剂稍过量):
请回答以下问题:
(1)为操作Ⅳ选择所需仪器(用标号字母填写):________。
| A.烧杯 | B.试管 | C.玻璃棒 | D.分液漏斗 E.漏斗 F.酒精灯 |
(2)操作Ⅲ中常用Na2CO3溶液、NaOH溶液、BaCl2溶液作为除杂试剂,则加入除杂试剂的顺序为:NaOH溶液→________→________。
(3)操作Ⅲ中,判断加入BaCl2已过量的方法是_________________________。
(4)操作Ⅴ应选择的酸是________,若将操作Ⅴ与操作Ⅳ的先后顺序对调,将会对实验结果产生的影响是__________________________________________。
(5)操作Ⅵ是________(选择合理操作的名称,用标号字母按操作先后顺序填写)。
a.过滤、洗涤 b.蒸发、浓缩 c.萃取、分液 d.冷却、结晶 查看习题详情和答案>>
用粗盐(含Ca2+ 、Mg2+ 、SO42- 、CO32-和泥沙等杂质)制备医用级纯度的NaCl,并测定医用NaCl的百分含量。某化学研究性学习小组成员设计了如下实验步骤:
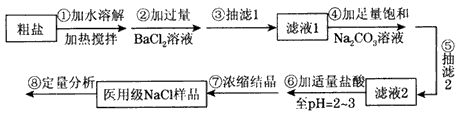
根据以上信息回答下列有关问题:
(1)步骤②中加入BaCl2溶液过量的原因:___________
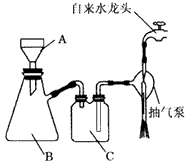
(2)步骤③中抽滤装置如图,仪器C的名称:________;
(1)步骤②中加入BaCl2溶液过量的原因:___________
(2)步骤③中抽滤装置如图,仪器C的名称:________;
(3)若省略步骤“③抽滤1”后,能否通过步骤“⑤抽滤2”同时除去BaSO4和 CaCO3等沉淀,从沉淀溶解平衡的角度说明理由:____;
(4)步骤⑦浓缩与结晶操作时,当出现下列现象_________时,停止加热(填序号);
A.蒸发皿液面上出现极薄晶膜
B.蒸发皿底部刚出现细小晶粒
C.蒸发皿底部出现大量的晶体
D.蒸发皿中溶液全部蒸干
(5)取1.00 g干燥的医用级NaCl样品溶解于适量蒸馏水中,向其中加入含AgNO3 3.40 g的AgNO3溶液,Cl-即被完全沉淀。然后用Fe3+作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以白色AgSCN沉淀的形式析出。
①滴定达到终点时,溶液呈红色,且半分钟内不褪色,写出表示该现象的离子方程式:____;
②在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n(Cl-)的测定结果________(选填“偏高”“偏低”或“无影 响”)。
③若用0.100 mol·L-1 NH4SCN标准溶液滴定剩余的AgNO3时,用去上述浓度的NH4SCN溶液30.0 mL,则此医用级氯化钠样品中NaCl的百分含量为 ____。
查看习题详情和答案>>
(4)步骤⑦浓缩与结晶操作时,当出现下列现象_________时,停止加热(填序号);
A.蒸发皿液面上出现极薄晶膜
B.蒸发皿底部刚出现细小晶粒
C.蒸发皿底部出现大量的晶体
D.蒸发皿中溶液全部蒸干
(5)取1.00 g干燥的医用级NaCl样品溶解于适量蒸馏水中,向其中加入含AgNO3 3.40 g的AgNO3溶液,Cl-即被完全沉淀。然后用Fe3+作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以白色AgSCN沉淀的形式析出。
①滴定达到终点时,溶液呈红色,且半分钟内不褪色,写出表示该现象的离子方程式:____;
②在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n(Cl-)的测定结果________(选填“偏高”“偏低”或“无影 响”)。
③若用0.100 mol·L-1 NH4SCN标准溶液滴定剩余的AgNO3时,用去上述浓度的NH4SCN溶液30.0 mL,则此医用级氯化钠样品中NaCl的百分含量为 ____。
为除去粗盐中含有的Ca2+、Mg2+、Fe3+、![]() 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):称取粗盐
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):称取粗盐![]() 滤液
滤液![]()
![]() 精盐.
精盐.
(1)判断BaCl2已过量的方法是________.
(2)第④步中相关的离子方程式是________.
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是________.
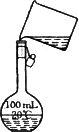
(4)为检验精盐纯度,需配制150 mL 0.2 mol·L-1 NaCl(精盐)溶液,如图是该同学转移溶液的示意图,图中的错误是________.
电解法制碱的原料是饱和食盐水,由于粗盐中含有泥沙和Ca2+、Mg2+、Fe3+、SO42-杂质,不符合电解要求,因此必须经过精制.某校实验小组精制粗盐水的实验过程如下:
请回答以下问题:
(1)操作a的名称是 ,所用玻璃仪器有 ;
(2)在Ⅱ步中,加入过量试剂甲后,生成了两种大量的难溶沉淀,则试剂甲为 (填化学式)溶液;
(3)写出固体H所含物质的化学式 ;
(4)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的;
溶解时: .
过滤时: .
蒸发时: .
查看习题详情和答案>>

请回答以下问题:
(1)操作a的名称是
(2)在Ⅱ步中,加入过量试剂甲后,生成了两种大量的难溶沉淀,则试剂甲为
(3)写出固体H所含物质的化学式
(4)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的;
溶解时:
过滤时:
蒸发时:
电解法制碱的原料是饱和食盐水,由于粗盐中含有泥沙和Ca2+、Mg2+、Fe3+、SO42-杂质,不符合电解要求,因此必须经过精制.某校实验小组精制粗盐水的实验过程如下:

请回答以下问题:
(1)操作a的名称是
(2)在Ⅱ步中,加入过量试剂甲后,生成了两种大量的难溶沉淀,则试剂甲为(填化学式)
(3)写出固体H所含物质的化学式
(4)在Ⅴ步中,逐滴加入试剂丁直至溶液无明显变化时,写出此过程中发生反应的离子方程式
查看习题详情和答案>>

请回答以下问题:
(1)操作a的名称是
过滤
过滤
,所用玻璃仪器有烧杯、漏斗、玻璃棒
烧杯、漏斗、玻璃棒
;(2)在Ⅱ步中,加入过量试剂甲后,生成了两种大量的难溶沉淀,则试剂甲为(填化学式)
NaOH
NaOH
溶液;(3)写出固体H所含物质的化学式
BaCO3、CaCO3
BaCO3、CaCO3
;(4)在Ⅴ步中,逐滴加入试剂丁直至溶液无明显变化时,写出此过程中发生反应的离子方程式
H++OH-=H2O
H++OH-=H2O
;2H++CO32-=CO2↑+H2O
2H++CO32-=CO2↑+H2O
.