摘要:26.按要求填空 (1)完成并配平下面的化学方程式.标出电子转移的方向和数目 □Na2Cr2O7+□KI+□HCl→□CrCl3+□NaCl+□KCl+□I2+□ (2)向漂白粉溶液中分别逐渐通入下列气体.最终能使 HClO浓度增大的是 A.逐渐通入CO2 B.逐渐通入SO2 C.逐渐通入 HCl D.逐渐通入Cl2 写出C选项中反应的化学方程式 (3)已知常温下燃烧7.8g乙炔生成二氧化碳和液态水时.放出389.5kJ的热量.写出乙炔燃烧的热化学反应方程式 (4)某离子晶体结构单元如图.试推测: ①晶体中每个Y同时吸引着 个X.每个X同时吸引着 个Y. 该晶体的化学式为 , ②晶 体 中 在 每 个 X 周 围 与 它 最 接 近 且 距 离 相等的X共有 个, ③晶体中距离最接近的2个X与一个Y形成的夹角∠XYX角度为
网址:http://m.1010jiajiao.com/timu3_id_409178[举报]
(2013?安徽模拟)亚硝酸盐是一祌常见的食品添加剂,使用时必须严格控制其用量.为检测某食品中亚硝 酸盐含量(通常以1kg样品中含NaN02的质量计),某研究小组设计了如下两种实验方案: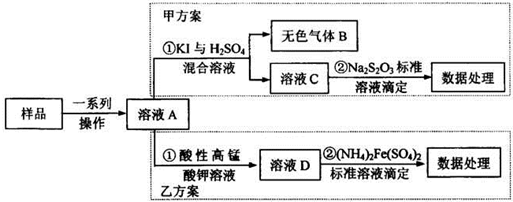
(1)无色气体B遇空气显红棕色,B的化学式为
(2)完成并配平乙方案①中反应的离子方程式
(3)乙方案②中需配置100mL0.0010mol/L(NH4)2Fe(SO4)2标准溶液,在已准确称量样品的质量后,还需要的仪器有:量筒、烧杯、
(4)若取样品ag,按乙方案进行测定,准确量取12.00mL0.0005mol/L的酸性高锰酸钾 溶液(过童)与溶液A反应.反应后溶液用0.0010mol/L(NH4)2Fe(SO4)2标准溶液滴定至紫色 溶液刚好褪去;重复上述实验2次,平均消耗(NH4)2Fe(SO4)2溶液1O.OOmL.则1kg样品中 NaNO2的质量为
mg.
查看习题详情和答案>>

(1)无色气体B遇空气显红棕色,B的化学式为
NO
NO
写出甲方案①中反应的离子方程式2I-+2NO2-+4H+=I2+2NO↑+2H2O
2I-+2NO2-+4H+=I2+2NO↑+2H2O
(2)完成并配平乙方案①中反应的离子方程式
2
2
MnO4-+5
5
NO2+6
6
=2
2
Mn 2++5
5
NO3-+3
3
(3)乙方案②中需配置100mL0.0010mol/L(NH4)2Fe(SO4)2标准溶液,在已准确称量样品的质量后,还需要的仪器有:量筒、烧杯、
玻璃棒、100mL容量瓶、胶头滴管
玻璃棒、100mL容量瓶、胶头滴管
配制溶液时,定容的操作方法是向容量瓶中注入蒸馏水,当液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至液面与刻度线相切.
向容量瓶中注入蒸馏水,当液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至液面与刻度线相切.
(4)若取样品ag,按乙方案进行测定,准确量取12.00mL0.0005mol/L的酸性高锰酸钾 溶液(过童)与溶液A反应.反应后溶液用0.0010mol/L(NH4)2Fe(SO4)2标准溶液滴定至紫色 溶液刚好褪去;重复上述实验2次,平均消耗(NH4)2Fe(SO4)2溶液1O.OOmL.则1kg样品中 NaNO2的质量为
| 690 |
| a |
| 690 |
| a |
 (1)已知离子反应:RO3n-+6I-+6H+=R-+3I2+3H2O,n=
(1)已知离子反应:RO3n-+6I-+6H+=R-+3I2+3H2O,n=1
1
,R元素在RO3n-中的化合价是+5
+5
.(2)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质.例如:
①在上述有编号的步骤中,需用氧化剂的是
④
④
(填编号).②完成并配平下列反应的化学方程式,按要求标出电子转移的方向和数目,并回答问题:
1
1
Na2Cr2O7+6
6
KI+14
14
HCl--2
2
CrCl3+_NaCl+6
6
KCl+3
3
I2+ (用单线桥表示电子转移的方向、数目)当反应中有3mol电子转移时,氧化产物的质量是
(用单线桥表示电子转移的方向、数目)当反应中有3mol电子转移时,氧化产物的质量是381g
381g
.(12分)(1)已知离子反应: +6I—+6H+=R—+3I2+3H2O,n= ,R元素在
+6I—+6H+=R—+3I2+3H2O,n= ,R元素在 中的化合价是 。
中的化合价是 。
(2)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:

① 在上述有编号的步骤中,需用氧化剂的是 (填编号)。
②完成并配平下列反应的化学方程式,按要求标出电子转移的方向和数目,并回答问题:
__Na2Cr2O7+__KI+__HCl——__CrCl3+_NaCl+__KCl+__I2+ (用单线桥表示电子转移的方向、数目)
(用单线桥表示电子转移的方向、数目)
当反应中有3mol电子转移时,氧化产物的质量是 。
查看习题详情和答案>>
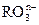 +6I—+6H+=R—+3I2+3H2O,n= ,R元素在
+6I—+6H+=R—+3I2+3H2O,n= ,R元素在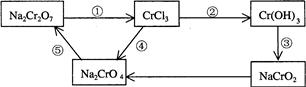
 (用单线桥表示电子转移的方向、数目)
(用单线桥表示电子转移的方向、数目)