摘要:原理:被检液中滴入少量__酸化.再滴入__溶液.若产生__.则可断定溶液中含有氯离子.不可用盐酸酸化.酸化目的是防止影响. + AgNO3(aq) → + 稀硝酸 →白色↓ 解释:Ag+ + Cl- = AgCl↓ 2Ag+ + CO32- = Ag2CO3↓ Ag2CO3 + 2H+ = 2Ag+ + H2O + CO2↑ 疑难点拨
网址:http://m.1010jiajiao.com/timu3_id_406539[举报]
 (2011?肇庆二模)请回答有关锌及其化合物的问题.
(2011?肇庆二模)请回答有关锌及其化合物的问题.(1)高温锻烧时,闪锌矿(ZnS)与氧气反应生成ZnO和SO2.其反应方程式为:
2ZnS+3O2═2ZnO+2SO2
2ZnS+3O2═2ZnO+2SO2
,该反应1mol还原剂失去电子6
6
mol.(2)已知Zn(OH)2具有两性,在过量的强碱性溶液中生成可溶于水的Zn(OH)42-.右图是Zn2+在某温度时水解、沉淀、溶解的曲线图.
①当pH=7、c(Zn2+)=0.01mol?L-1,Zn元素主要存在形式为
Zn2+
Zn2+
、ZnOH+(或Zn(OH)2)
ZnOH+(或Zn(OH)2)
(写化学式).②向c(Zn2+)=1×10-5mol?L-1的溶液中加入固体NaOH到pH=13,其反应的离子方程式为
Zn2++4OH-═Zn(OH)42-或分步写:Zn2++2OH-═Zn(OH)2↓
Zn(OH)2+2OH-═Zn(OH)42-
Zn(OH)2+2OH-═Zn(OH)42-
Zn2++4OH-═Zn(OH)42-或分步写:Zn2++2OH-═Zn(OH)2↓
Zn(OH)2+2OH-═Zn(OH)42-
.Zn(OH)2+2OH-═Zn(OH)42-
③已知该温度下的Ksp[Zn(OH)2]=1×10-17、Ksp(ZnS)=1.6×10-24.当向新生成的Zn(OH)2浊液中滴入足量的Na2S溶液,振荡后Zn(OH)2会全部转化为ZnS,其原理是:
由于在Zn(OH)2浊液存在溶解平衡:Zn(OH)2(s) Zn2+(aq)+2OH-(aq),而Ksp[Zn(OH)2]>Ksp(ZnS),滴入的S2-与Zn2+结合生成了更难溶(或溶度积更小)的ZnS,使Zn2+浓度减小,溶解平衡继续向右移动直至全部转化为ZnS
Zn2+(aq)+2OH-(aq),而Ksp[Zn(OH)2]>Ksp(ZnS),滴入的S2-与Zn2+结合生成了更难溶(或溶度积更小)的ZnS,使Zn2+浓度减小,溶解平衡继续向右移动直至全部转化为ZnS
 Zn2+(aq)+2OH-(aq),而Ksp[Zn(OH)2]>Ksp(ZnS),滴入的S2-与Zn2+结合生成了更难溶(或溶度积更小)的ZnS,使Zn2+浓度减小,溶解平衡继续向右移动直至全部转化为ZnS
Zn2+(aq)+2OH-(aq),而Ksp[Zn(OH)2]>Ksp(ZnS),滴入的S2-与Zn2+结合生成了更难溶(或溶度积更小)的ZnS,使Zn2+浓度减小,溶解平衡继续向右移动直至全部转化为ZnS由于在Zn(OH)2浊液存在溶解平衡:Zn(OH)2(s) Zn2+(aq)+2OH-(aq),而Ksp[Zn(OH)2]>Ksp(ZnS),滴入的S2-与Zn2+结合生成了更难溶(或溶度积更小)的ZnS,使Zn2+浓度减小,溶解平衡继续向右移动直至全部转化为ZnS
Zn2+(aq)+2OH-(aq),而Ksp[Zn(OH)2]>Ksp(ZnS),滴入的S2-与Zn2+结合生成了更难溶(或溶度积更小)的ZnS,使Zn2+浓度减小,溶解平衡继续向右移动直至全部转化为ZnS
. Zn2+(aq)+2OH-(aq),而Ksp[Zn(OH)2]>Ksp(ZnS),滴入的S2-与Zn2+结合生成了更难溶(或溶度积更小)的ZnS,使Zn2+浓度减小,溶解平衡继续向右移动直至全部转化为ZnS
Zn2+(aq)+2OH-(aq),而Ksp[Zn(OH)2]>Ksp(ZnS),滴入的S2-与Zn2+结合生成了更难溶(或溶度积更小)的ZnS,使Zn2+浓度减小,溶解平衡继续向右移动直至全部转化为ZnS如图所示:甲、乙为相互串联的两电解池.试回答:
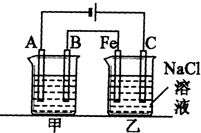
(1)乙池反应中C极产物的检验方法为:
(2)甲池若为用电解原理精炼铜的装置,则A电极名称为
查看习题详情和答案>>

(1)乙池反应中C极产物的检验方法为:
利用湿润的淀粉碘化钾试纸变蓝检验
利用湿润的淀粉碘化钾试纸变蓝检验
,乙池中Fe极电极反应式为2H++2e-═H2↑
2H++2e-═H2↑
,若在乙池中滴入少量酚酞试液,开始电解一段时间,铁极附近呈变红
变红
色,原因是:溶液中氢离子得到电子生成氢气,破坏水的电离平衡,氢氧根离子浓度增大显碱性
溶液中氢离子得到电子生成氢气,破坏水的电离平衡,氢氧根离子浓度增大显碱性
.(2)甲池若为用电解原理精炼铜的装置,则A电极名称为
阴
阴
极,电极材料是纯铜
纯铜
,电极反应式为Cu2++2e-═Cu
Cu2++2e-═Cu
,电解质溶液可以是含铜离子的盐溶液
含铜离子的盐溶液
.若甲池A极增重12.8g,则乙池C(石墨)极放出气体在标况下的体积为4.48L
4.48L
.电解后,若乙池剩余溶液为400mL,则溶液的pH=14
14
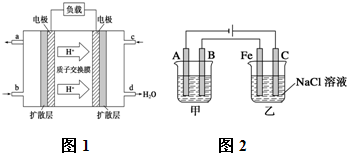
.Ⅰ.已知甲醇燃料电池的工作原理如图1所示.
①该电池工作时,b口通入的物质为
②该电池负极的电极反应式为
Ⅱ.如图2所示:甲、乙为相互串联的两电解池.试答:
(1)乙池中C极电极反应式为
(2)甲池若为用电解原理精炼铜的装置,则A电极名称为
查看习题详情和答案>>
①该电池工作时,b口通入的物质为
CH3OH
CH3OH
,c口通入的物质为O2
O2
.②该电池负极的电极反应式为
CH3OH+H2O-6e-═CO2+6H+
CH3OH+H2O-6e-═CO2+6H+
.Ⅱ.如图2所示:甲、乙为相互串联的两电解池.试答:
(1)乙池中C极电极反应式为
2Cl--2e-═Cl2↑
2Cl--2e-═Cl2↑
,若在乙池中滴入少量酚酞试液,开始电解一段时间,铁极附近呈红
红
色.(2)甲池若为用电解原理精炼铜的装置,则A电极名称为
阴
阴
极,电极反应式为Cu2++2e-═Cu
Cu2++2e-═Cu
,溶液可以是CuSO4溶液或CuCl2溶液
CuSO4溶液或CuCl2溶液
.
 如图所示:甲、乙为相互串联的两电解池.试回答:
如图所示:甲、乙为相互串联的两电解池.试回答:(1)乙池中Fe极电极反应式为
2H++2e-═H2↑
2H++2e-═H2↑
,若在乙池中滴入少量酚酞试液,开始电解一段时间,铁极附近呈红
红
色.(2)甲池若为用电解原理精炼铜(假设粗铜的组成是均匀的,且比其活泼和不活泼的成分均存在)的装置,则A电极材料为
精铜
精铜
,电极反应式为Cu2++2e-═Cu
Cu2++2e-═Cu
,电解质溶液可以是CuSO4
CuSO4
;通电一段时间后,A极增重12.8g,则甲池溶液原溶质的浓度减小
减小
(填“增大”、“减小”、“不变”或“无法确定”),乙池C(石墨)极放出气体在标准状况下的体积为4.48
4.48
L,此时乙池剩余溶液的体积为400mL,则溶液的c(OH-)1mol/L
1mol/L
.若要使乙池溶液恢复到电解前的状态,可向溶液中加入HCl
HCl
(填写物质的化学式)14.6
14.6
g. 选考题[化学--选修化学与生活]
选考题[化学--选修化学与生活]Ⅰ.维生素C的结构简式是
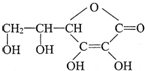 ,它的分子式是
,它的分子式是C6H8O6
C6H8O6
.由于它能防治坏血病,又称为抗坏血酸
抗坏血酸
.在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有酸
酸
性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是溶液蓝色褪色
溶液蓝色褪色
,说明维生素C具有还原性
还原性
性.Ⅱ.(1)如右图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)
Ⅰ>Ⅲ>Ⅱ
Ⅰ>Ⅲ>Ⅱ
.(2)氟氯代烷是一种能破坏臭氧层的物质.在大气平流层中,氟氯代烷受紫外线的照射分解出氯原子,氯原子参与下列有关反应:①Cl+O3→ClO+O2 ②O3→O+O2 ③ClO+O→Cl+O2上列的反应的总反应式是
2O3→3O2
2O3→3O2
,少量氟氯代烷能破坏大量臭氧的原因是氟氯代烷分解产生的Cl对O3的分解有促进作用
氟氯代烷分解产生的Cl对O3的分解有促进作用
.