摘要:表示化学键的式子--电子式和结构式 (1)原子.离子.化合物的电子式怎样写?应注意什么问题? 怎样用电子式表示离子化合物和共价化合物的形成过程. (2)如何来书写结构式
网址:http://m.1010jiajiao.com/timu3_id_405863[举报]
[化学──选修物质结构与性质]
图表法、图象法是常用的科学研究方法.下表列出前20号元素中的某些元素性质的一些数据:
试回答下列问题:
(1)以上10种元素中第一电离能最小的是: (填编号).比元素B原子序数大10的元素在元素周期表中的位置: 周期, 族,其基态原子的核外电子排布是 .
(2)由上述C、E、G三种元素中的某两种元素形成的化合物中,每个原子的最外层都满足8电子稳定结构的可能是 (写分子式,写出两种即可),元素G、I分别和J形成的两种化合物的晶体类型分别是 .
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子.其分子中共形成 个σ键, 个π键.
(4)短周期某主族元素K的电离能情况如图(A)所示.则K元素位于周期表的第 族.

图B是研究部分元素的氢化物的沸点变化规律的图象,折线c可以表达出第 族元素氢化物的沸点的变化规律.不同同学对某主族元素的氢化物的沸点的变化趋势画出了两条折线-折线a和折线b,你认为正确的是 ,理由是 .
查看习题详情和答案>>
图表法、图象法是常用的科学研究方法.下表列出前20号元素中的某些元素性质的一些数据:
| 元素 性质 |
A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |
(1)以上10种元素中第一电离能最小的是:
(2)由上述C、E、G三种元素中的某两种元素形成的化合物中,每个原子的最外层都满足8电子稳定结构的可能是
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子.其分子中共形成
(4)短周期某主族元素K的电离能情况如图(A)所示.则K元素位于周期表的第

图B是研究部分元素的氢化物的沸点变化规律的图象,折线c可以表达出第
[化学选修-物质结构与性质](13分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+离子M层3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)A的氢化物的分子空间构型是 ,其中心原子采取 杂化,属于 (填“极性分子”和“非极性分子”)。
(3)F和M(质子数为25)两元素的部分电离能数据列于下表:
| 元 素 | M | F | |
| 电离能 (kJ·mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(4)晶体熔点:DC EC(填“<、=、>”),原因是 。
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
| | 熔点/K | 沸点/K | 标准状况时在水中的溶解度 |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
(6)已知某化合反应,在反应过程中只有σ键的断裂与生成,写出符合要求的化学方程式
(写一个)。 查看习题详情和答案>>
[化学-物质结构与性质]
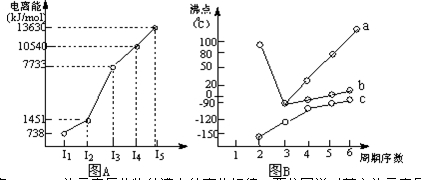
Ⅰ.短周期某主族元素M的电离能如图(A)所示.则M元素位于周期表的第______族.
Ⅱ.图B折线c可以表达出第______族元素氢化物的沸点的变化规律.两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:______(填“a”或“b”)
Ⅲ.氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.
(1)写出这三种元素电负性由大到小的顺序______(填元素符号)
(2)砷原子核外电子排布式为______
(3)K3[Fe(CN)6]晶体中Fe3+与CN-之间的化学键类型为______,该化学 键能够形成的原因是______.
查看习题详情和答案>>

Ⅰ.短周期某主族元素M的电离能如图(A)所示.则M元素位于周期表的第______族.
Ⅱ.图B折线c可以表达出第______族元素氢化物的沸点的变化规律.两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:______(填“a”或“b”)
Ⅲ.氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.
(1)写出这三种元素电负性由大到小的顺序______(填元素符号)
(2)砷原子核外电子排布式为______
(3)K3[Fe(CN)6]晶体中Fe3+与CN-之间的化学键类型为______,该化学 键能够形成的原因是______.
化学--物质结构与性质
I、为减少温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2.
(1)若有1mol CH4生成,则有______molσ键和______molπ键断裂.
(2)CH4失去H-(氢负离子)形成CH+3(甲基正离子).已知CH+3的空间结构是平面正三角形,则CH+3中碳原子的杂化方式为______.
Ⅱ、金属原子与CO形成的配合物称为金属羰基配合物(如羰基铁).形成配合物时,每个CO提供一对电子与金属原子形成配位键,且金属原子的价电子和CO提供的电子总和等于18.
(3)金属羰基配合物中,微粒间作用力有______(填字母代号)
a、离子键 b、共价键 c、配位键 d、金属键
(4)羰基铁是一种黄色油状液体,熔点-21℃、沸点102.8℃.由此推测,固体羰基铁更接近于______(填晶体类型).若用Fe(CO)x表示羰基铁的化学式,则x=______.
III.研究表明,对于中心离子为Hg+等阳离子的配合物,若配位体给出电子能力越强:则配位体与中心离子形成的配位键就越强,配合物也就越稳定.
(5)预测HgCl24与HgI2-4的稳定性强弱,并从元素电负性的角度加以解释.
答:HgCl2-4比HgI2-4更______(填“稳定”或“不稳定”),因为______.
查看习题详情和答案>>
I、为减少温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2.
(1)若有1mol CH4生成,则有______molσ键和______molπ键断裂.
(2)CH4失去H-(氢负离子)形成CH+3(甲基正离子).已知CH+3的空间结构是平面正三角形,则CH+3中碳原子的杂化方式为______.
Ⅱ、金属原子与CO形成的配合物称为金属羰基配合物(如羰基铁).形成配合物时,每个CO提供一对电子与金属原子形成配位键,且金属原子的价电子和CO提供的电子总和等于18.
(3)金属羰基配合物中,微粒间作用力有______(填字母代号)
a、离子键 b、共价键 c、配位键 d、金属键
(4)羰基铁是一种黄色油状液体,熔点-21℃、沸点102.8℃.由此推测,固体羰基铁更接近于______(填晶体类型).若用Fe(CO)x表示羰基铁的化学式,则x=______.
III.研究表明,对于中心离子为Hg+等阳离子的配合物,若配位体给出电子能力越强:则配位体与中心离子形成的配位键就越强,配合物也就越稳定.
(5)预测HgCl24与HgI2-4的稳定性强弱,并从元素电负性的角度加以解释.
答:HgCl2-4比HgI2-4更______(填“稳定”或“不稳定”),因为______.
查看习题详情和答案>>
[化学一选修3物质结构与性质]
下表为长式周期表的一部分,其中的字母A--J分别代表对应的10种元素.

请回答下列问题:
(1)元素I的原子结构示意图为______.
(2)B、E两元素分别与元素C按原子个数比为1:2形成化合物时,中心原子的杂化方式分别为______和______,这两种化合物的熔沸点差别很大的原因是______.
(3)H3+离子在一定条件下能形成结构复杂的配离子[HG(A2C)5]2+形成该配离子时,H3+离子接受了配体提供的______.该配离子中含有的化学键类型是______,其中G的核外电子排布式为______.
(4)元素D与元素G形成的化合物DG的晶胞结构如图所示,每个D离子周围与之最近的D离子的个数为______.若设该晶胞的棱长为a cm,阿伏加德罗常数的值为NA,则该化合物的密度为______.
 查看习题详情和答案>>
查看习题详情和答案>>
下表为长式周期表的一部分,其中的字母A--J分别代表对应的10种元素.

请回答下列问题:
(1)元素I的原子结构示意图为______.
(2)B、E两元素分别与元素C按原子个数比为1:2形成化合物时,中心原子的杂化方式分别为______和______,这两种化合物的熔沸点差别很大的原因是______.
(3)H3+离子在一定条件下能形成结构复杂的配离子[HG(A2C)5]2+形成该配离子时,H3+离子接受了配体提供的______.该配离子中含有的化学键类型是______,其中G的核外电子排布式为______.
(4)元素D与元素G形成的化合物DG的晶胞结构如图所示,每个D离子周围与之最近的D离子的个数为______.若设该晶胞的棱长为a cm,阿伏加德罗常数的值为NA,则该化合物的密度为______.
 查看习题详情和答案>>
查看习题详情和答案>>