网址:http://m.1010jiajiao.com/timu3_id_405861[举报]
 元素周期表中第四周期的金属元素在生产和科研中有非常重要的使用价值.
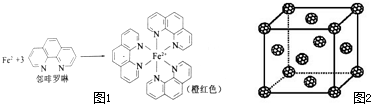
元素周期表中第四周期的金属元素在生产和科研中有非常重要的使用价值.(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰.相关的反应如下:
4FeCl3+2NH2OH?HCl→4FeCl2+N2O↑+6HCl+H2O
①Fe2+在基态时,核外电子排布式
②羟胺中(NH2OH)采用SP3杂化的原子有
③Fe2+与邻啡罗啉形成的配合物中,配位数为
(2)向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体,该晶体中含有的化学键类型是
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+,已知NF3与NH3的空间构型都是三角锥形,但NF3 不易与Cu2+形成配离子,其原因是
(4)配合物Ni(CO)4常温下呈液态,易溶于CCl4、苯等有机溶剂.固态Ni(CO)4属于
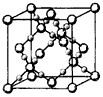
(5)如果把晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,第四周 期电负性最小的原子可作为容体掺入C60 晶体的空隙中,形成具有良好的超导性的掺杂C60 化合物.现把C60抽象成质点,该晶体的晶胞结构如图2所示,若每个四面体空隙填入一个原子,则全部填满C60 晶体的四面体空隙后,所形成的掺杂C60 化合物的化学式为
(2)据最新报道,液氨有望成为汽车用清洁燃料。氨分子的空间构型为____________,氨易液化的主要原因是_____________________。
(3)乙烯的年产量可用于衡量一个国家石油化学工业水平。在乙烯分子中,σ键和π键的个数比为____,乙烯分子是____(填“极性”或“非极性”) 分子。
(4)含碳物质不完全燃烧会产生CO。血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人 中毒。亚铁离子的基态电子排布式为_______;CO有多种等电子体,其中常见的两种为__________。
请填写下列空白:
(1)写出元素符号:X______、Y______、Z______、W_______。
(2)X元素的单质和Z元素的单质在一定条件下反应生成化合物E,该反应的化学方程式为________
______________,E分子的空间构型为_________。
(3)仅由X、Z、W三种元素组成的某种常见盐是一种速效肥,但长期施用会使土壤酸化。写出导致土壤酸化的离子方程式:________________________。
(4)这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序),该化合物的水溶液与足量稀NaOH溶液会发生反应,写出反应的离子方程式:________________________________________。 查看习题详情和答案>>
(1)请写出元素符号∶X________Y________;Z________;W________.
(2)X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为(请注明反应条件)_________________________________;E分子的空间构型为________电子式为________;E在催化剂存在的条件下,可用于还原汽车尾气中的________,以减少对大气的污染.
(3)仅由X、Z、W三种元素组成的某种盐是一种速效肥料,但长期施用会使土壤酸化,有关的离子方程式为__________________________.
(4)这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序),该化合物的水溶液与足量NaOH溶液反应的离子方程式为____________________.
(5)将9g
Y单质在足量W单质中燃烧,所得气体通入1L 1mol·![]() 的NaOH溶液中.完全吸收后,溶液中的离子浓度由大到小的顺序是____________________.
的NaOH溶液中.完全吸收后,溶液中的离子浓度由大到小的顺序是____________________.
查看习题详情和答案>>
| |||||||||||||||||||||||