摘要:3 分析与综合 提问:①“H2S←S→SO2→SO3 中物质向右转化是一个什么过程?[氧化] ②连续向右转化是什么过程?[连续氧化] ③写出连续氧化的具体路径.[H2S→S→SO2→SO3,H2S→SO2→SO3,FeS→SO2→SO3,FeS2→SO2→SO3等] ④分析连续氧化的特点.[低价元素分步失去电子.化合价逐渐升高.逐步被氧化] ⑤分析连续氧化的条件.[该元素至少存在三个价态] 任务:指出连续还原有哪些具体的路径.并分析连续还原的特点和条件. 过渡:高价元素一般具有氧化性.低价元素一般具有还原性.高价元素和低价元素往往能够发生什么反应?[归中反应]有何特点?[生成中间价物质]有什么条件?[必须存在中间价]具体有哪些反应? 交流:S+2H2SO4(浓)=△=3SO2↑+2H2O,S+2SO3==3SO2↑,2H2S+SO2=2H2O+3S. 思考:①“H2SO3→NaHSO3→Na2SO3 的转化有什么特点?[逐步失去H+.“连续碱化 ]②类似的过程有哪些? ③如果逆向进行呢?[逐步得到H+.“连续酸化 ]
网址:http://m.1010jiajiao.com/timu3_id_405850[举报]
小资料:1775年法国化学家拉瓦锡在定量研究空气组成时,发现从空气中分离得到N2的密度与分离含氮物质得到N2的密度之间总有一个微小的差异,但这并没引起他的注意.一百多年后,英国科学家雷利对这0.0064 g·cm-3的差异进行了分析,几经努力,他终于发现在空气中还存在着一种懒惰的气体——氩气,从而发现了惰性气体家族.
(1)阅读资料,你有哪些感受?
(2)下面是科学家雷利在实验探究中的几个重要步骤,请补充完整:
问题与猜想→( )![]() 分析与结论
分析与结论![]() ( )
( )
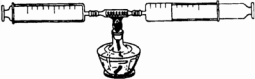
(3)某同学在探究空气成分中氧气的含量时,模拟了科学家的探究过程.他设计了如下实验:在由两个注射器组成的密闭容器内留有25 mL空气,给装有细铜丝的玻璃管加热(如图).请你与之合作,继续完成该实验的探究.
 向某NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同.若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)、(3)、(4)图中分别为OA<AB,OA=AB,OA>AB,则下列分析与判断正确的是(不计CO2的溶解)( )
向某NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同.若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)、(3)、(4)图中分别为OA<AB,OA=AB,OA>AB,则下列分析与判断正确的是(不计CO2的溶解)( )
查看习题详情和答案>>
向某NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同.若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)中有OA<AB,(3)中有OA=AB,(4)中有OA>AB,则下列分析与判断不正确的是(不计CO2的溶解)( )

查看习题详情和答案>>
(2011?安徽模拟)苯甲酸甲酯(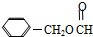 )是一种重要的工业使用的有机溶剂.分析如图的框图关系,然后回答问题:
)是一种重要的工业使用的有机溶剂.分析如图的框图关系,然后回答问题: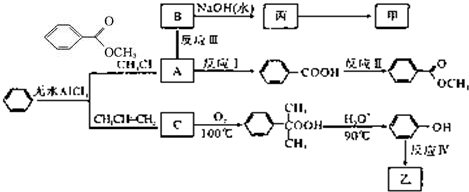
已知以下信息:
①有机化合物甲的结构: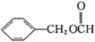
②有机化合物乙的结构: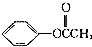
③有机化合物丙的分子式为C7H8O,熔融状态的丙能与钠反应放出氢气,且能够与乙酸发生酯化反应;
④苯在无水AlCl3的作用下与卤代烃、烯烃发生反应,可以在苯环上增加烷基.
(1)乙中含氧官能团的名称
(2)甲、乙、丙三种有机物中与苯甲酸甲酯是同分异构体的是
(3)写出C的结构简式: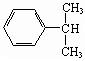
 .
.
(4)丙生成甲的反应类型与
a.反应I b.反应Ⅱc.反应Ⅲd.反应Ⅳ
(5)写出B生成丙的化学方程式: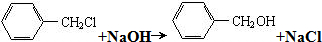
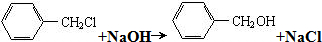 .
.
查看习题详情和答案>>
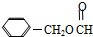 )是一种重要的工业使用的有机溶剂.分析如图的框图关系,然后回答问题:
)是一种重要的工业使用的有机溶剂.分析如图的框图关系,然后回答问题:
已知以下信息:
①有机化合物甲的结构:

②有机化合物乙的结构:
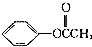
③有机化合物丙的分子式为C7H8O,熔融状态的丙能与钠反应放出氢气,且能够与乙酸发生酯化反应;
④苯在无水AlCl3的作用下与卤代烃、烯烃发生反应,可以在苯环上增加烷基.
(1)乙中含氧官能团的名称
酯基
酯基
.(2)甲、乙、丙三种有机物中与苯甲酸甲酯是同分异构体的是
甲、乙
甲、乙
,在加热条件下能够与新制氢氧化铜悬浊液反应生成砖红色沉淀的是甲
甲
,与NaOH溶液加热消耗NaOH最多的是乙
乙
.(3)写出C的结构简式:


(4)丙生成甲的反应类型与
bcd
bcd
(选填序号)的反应类型相同.a.反应I b.反应Ⅱc.反应Ⅲd.反应Ⅳ
(5)写出B生成丙的化学方程式:
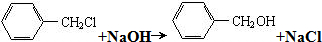
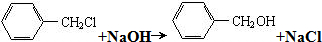
工业上由FeS2制H2SO4的转化关系如下:
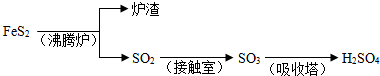
填写下列空白:
(1)已知吸收塔中每40gSO3气体被水完全吸收生成液态硫酸放出65.15kJ,写出该反应的热化学方程式
(2)接触室内发生的反应为:
SO2(g)+
O2(g)
SO3(g)△H=a kJ?mol-1
下表为不同温度(T)下该反应的化学平衡常数(K):
①根据上表数据及化学平衡理论,上述反应中a
②K值越大,表明反应达到平衡时
A.SO2的转化率一定越高 B.SO3的产量一定越大
C.正反应进行得越完全 D.化学反应速率越大
(3)考虑综合经济效益,当炉渣含铁量大于45%时,可用于制硫酸亚铁等.下列利用炉渣里的Fe2O3制FeSO4的方案中,最能体现绿色化学理念的方案是
A.Fe2O3
Fe
FeSO4;B.Fe2O3
Fe2(SO4)3
FeSO4;C.Fe2O3
Fe
FeSO4
(4)为了探究接触室里催化剂颗粒(粗颗粒和细颗粒),反应的温度(673K和723K),反应的压强(101Kpa和1010Kpa)对反应速率的影响,通过变换这些实验条件,至少需要完成
(5)为实现绿色环保、节能减排和废物利用等目的,某硫酸厂用碳酸钙作吸收剂与水配成浆液,洗涤尾气(SO2的体积分数为0.200%)并吸收SO2,得到石膏(CaSO4?2H2O).求:22.4m3(标准状况下)的尾气可制得石膏
(6)科学家研究出以图所示装置用电化学原理生产硫酸的新工艺,其阳极的电极反应式为
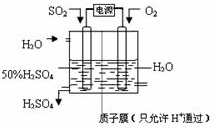
查看习题详情和答案>>

填写下列空白:
(1)已知吸收塔中每40gSO3气体被水完全吸收生成液态硫酸放出65.15kJ,写出该反应的热化学方程式
SO3(g)+H2O(l)=H2SO4(l)△H=-130.3kJ/mol
SO3(g)+H2O(l)=H2SO4(l)△H=-130.3kJ/mol
;(2)接触室内发生的反应为:
SO2(g)+
| 1 |
| 2 |
| ||
| △ |
下表为不同温度(T)下该反应的化学平衡常数(K):
| T/K | 673 | 723 | 823 | 923 |
| K | 423 | 37.4 | 20.5 | 4.68 |
<
<
0(填“>”或“<”);②K值越大,表明反应达到平衡时
C
C
(填标号).A.SO2的转化率一定越高 B.SO3的产量一定越大
C.正反应进行得越完全 D.化学反应速率越大
(3)考虑综合经济效益,当炉渣含铁量大于45%时,可用于制硫酸亚铁等.下列利用炉渣里的Fe2O3制FeSO4的方案中,最能体现绿色化学理念的方案是
B
B
(填标号);A.Fe2O3
| ||
| 高温 |
| 浓硫酸 |
| 浓硫酸 |
| 铁屑 |
| 铁粉 |
| 高温 |
| 浓硫酸 |
(4)为了探究接触室里催化剂颗粒(粗颗粒和细颗粒),反应的温度(673K和723K),反应的压强(101Kpa和1010Kpa)对反应速率的影响,通过变换这些实验条件,至少需要完成
4
4
个实验然后进行对比得出结论;(5)为实现绿色环保、节能减排和废物利用等目的,某硫酸厂用碳酸钙作吸收剂与水配成浆液,洗涤尾气(SO2的体积分数为0.200%)并吸收SO2,得到石膏(CaSO4?2H2O).求:22.4m3(标准状况下)的尾气可制得石膏
0.28
0.28
千克;(取两位有效数字)(设二氧化硫的利用率为80.0% )(6)科学家研究出以图所示装置用电化学原理生产硫酸的新工艺,其阳极的电极反应式为
SO2+2H2O-2e-=SO42-+4H+
SO2+2H2O-2e-=SO42-+4H+
,总反应的化学方程式为2SO2+O2+2H2O=2H2SO4
2SO2+O2+2H2O=2H2SO4
.