网址:http://m.1010jiajiao.com/timu3_id_405728[举报]
下表为长式周期表的一部分,其中的字母A--J分别代表对应的10种元素.

请回答下列问题:
(1)元素I的原子结构示意图为______.
(2)B、E两元素分别与元素C按原子个数比为1:2形成化合物时,中心原子的杂化方式分别为______和______,这两种化合物的熔沸点差别很大的原因是______.
(3)H3+离子在一定条件下能形成结构复杂的配离子[HG(A2C)5]2+形成该配离子时,H3+离子接受了配体提供的______.该配离子中含有的化学键类型是______,其中G的核外电子排布式为______.
(4)元素D与元素G形成的化合物DG的晶胞结构如图所示,每个D离子周围与之最近的D离子的个数为______.若设该晶胞的棱长为a cm,阿伏加德罗常数的值为NA,则该化合物的密度为______.
 查看习题详情和答案>>
查看习题详情和答案>>
| A | |||||||||||||||||
| B | C | D | E | F | |||||||||||||
| G | H | I | J | ||||||||||||||
| K | M | L |
(1)写出上表中元素D形成单质的电子式为


(2)元素K基态原子的电子排布式


(3)元素M位于周期表的第
(4)G、H、I 这三种元素的第一电离能由大到小的顺序是
(5)元素A、D、J按照原子个数比4:1:1形成的化合物的化学式为
(6)A、C、D 形成的ACD分子中,含有
(7)E、F、G、H这四种元素原子形成的简单阴、阳离子,按半径由小到大排列
(8)某些不同族元素的性质也有一定的相似性,如上表中元素B与元素I的氢氧化物有相似的性质,写出元素B的氢氧化物与NaOH溶液反应后盐的化学式
(9)元素L在一定条件下形成的晶体的基本结构单元如图1和图2所示,则在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为:

下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于ds区的元素是 (填编号)。
(2)表中元素①的2个原子与元素③的2个原子形成的分子中元素③的杂化类型是 ;
③和⑦形成的常见化合物的化学键类型是 。
(3)元素⑧的外围电子排布式为 ,该元素原子中未成对电子数为 。
(4)在周期表中位于对角线的元素的性质也有一定的相似性。试写出元素②的氢氧化物与NaOH溶液反应的化学方程式: .
(5)在1183 K以下,元素⑨形成如图1所示基本结构单元的晶体;1183 K以上,转变 为图2所示基本结构单元的晶体。


在1183 K以下的晶体中,与元素⑨的原子等距离且最近的原子数为 ;
在1183 K以上的晶体中,与元素⑨原子等距离且最近的原子数为 。
(B).
已知亚甲基蓝其氧化型呈蓝色,还原型呈无色,其转化关系式为:
![]()
奇妙的“蓝瓶子”实验就是利用上述原理,其装置如图1。


某校化学兴趣小组用图1装置进行下述实验:
①在250 mL锥形瓶中,依次加入2g NaOH、100mlH2O和2g葡萄糖,搅拌溶解后,再加入3~5滴0.2%的亚甲基蓝溶液,振荡混合液呈蓝色;
②塞紧橡皮塞,关闭活塞a、b,静置,溶液变为无色;
③打开活塞、振荡,溶液又变为蓝色;
④关闭活塞、静置,溶液又变为无色;
⑤以上步骤③、④可重复多次。
请回答下列问题:
(1)若塞紧图1中锥形瓶塞,并打开导管活塞a、b,从导管口(填“左”或“右”)通入足量氦气后,再关闭活塞a、b并振荡,溶液 (填“能”或“不能”)由无色变为蓝色。
(2)如图2所示:某学生将起初配得的蓝色溶液分装在A、B两支试管中,A试管充满溶液,B中有少量溶液,塞上橡皮塞静置片刻,两溶液均显无色。若再同时振荡A、B试管,溶液显蓝色的是 试管。
(3)上述转化过程中葡萄糖的作用是 ,亚甲基蓝的作用是
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为 。
(5)该实验中③、④操作 (填“能”或“不能”)无限次重复进行,理由是 。
查看习题详情和答案>>
(2)在元素②与①形成的气态化合物(水果催熟剂)中,元素②的杂化方式为________杂化,分子中σ键与π键之比为____。
(3)①~⑨元素的p亚层有两个单电子且第一电离能最大的元素名称是__________。 ②与④两种元素形成的化合物中,属于非极性分子的是__________(填化学式)。元素④与元素⑦形成的氢化物中,沸点由高到低的顺序为_____________(填化学式)。
(4)解释工业上制取⑥的单质是电解⑥的氧化物而不是氯化物的原因____________。
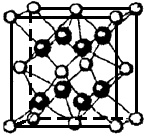
(5)⑤和⑧形成的离子化合物其晶胞结构如下图。该离子化合物晶胞的边长为 a cm,则晶体的密度是_________g·cm-3(只要求列出算式)。

(1)a分别与g、d形成的化合物中沸点较高的是___________(填化学式)。该分子中d原子的杂化方式为
___________。
(2)c、d、e、f元素的第一电离能(I1)由小到大的顺序为____________(用相应元素符号表示)。
(3)由表中元素形成的一种离子与单质d3互为等电子体,其化学式为_____________。
(4)元素h的二价阳离子的基态电子排布式为_______________
(5)研究发现,只含b、e、i三种元素的一种晶体具有超导性,其晶胞如下图所示。b原子的配位数为
_________;该晶体的化学式为_____________。

