摘要:16.①,⑧⑩,(8)④. (9)①⑤⑧⑩ 本资料由 提供!
网址:http://m.1010jiajiao.com/timu3_id_405049[举报]
 (2013?江苏三模)氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.
(2013?江苏三模)氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.(1)工业上以甲烷为原料制取氢气用于合成氨.有关反应的热化学方程式如下:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-846.3kJ?mol-1
CO(g)+O2(g)=CO2(g)△H=-282kJ?mol-1
H2(g)+O2(g)=H2O(g)△H=-241.8kJ?mol-1
CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为
CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+161.1kJ?mol-1
CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+161.1kJ?mol-1
.(2)氨气与二氧化碳反应可生成尿素[CO(NH2)2],该反应化学方程式为
2NH3+CO2?CO(NH2)2+H2O
2NH3+CO2?CO(NH2)2+H2O
;反应中的氨碳比和二氧化碳转化率的关系如图所示,则氨碳比最好控制在4.0
4.0
(填“3.0”或“4.0”)附近,理由是氨碳比小于4.0时,CO2的转化率太低
氨碳比小于4.0时,CO2的转化率太低
.(3)肼与亚硝酸反应可生成氮的另一种氢化物,在标准状况下,该氢化物气体的密度为1.92g?L-1,且其中氮元素的质量分数为0.977,该氢化物受撞击后可完全分解为两种单质气体.该氢化物分解的化学方程式为
2HN3?3N2+H2
2HN3?3N2+H2
.(4)以肼为原料的碱性燃料电池的电池反应为N2H4+O2=N2+2H2O,放电时,负极的电极反应式为
N2H4+4OH--4e-═N2+4H2O
N2H4+4OH--4e-═N2+4H2O
.(5)氨氧化法制硝酸工业尾气中的NO、NO2气体可用氨水吸收,反应的化学方程式为:6NO+4NH3=5N2+6H2O;6NO2+8NH3=7N2+12H2O.若尾气中的NO和NO2共18mol被氨水完全吸收后,产生了15.6mol氮气,则此尾气中NO与NO2的体积比为
9:1
9:1
.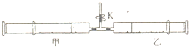 如图所示,将甲.乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(实验均在常温常压下进行).
如图所示,将甲.乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(实验均在常温常压下进行).| 实验序号 | 甲针筒内的物质 | 乙针筒内的物质 |
| 1 | 0.3gNa2CO3粉末 | 3mL稀HCl |
| 2 | 0.3gNaHCO3粉末 | 3mL稀HCl |
| 3 | 0.8gNa2O2粉末 | 3ml H2O |
(2)①实验3中的实验现象是:剧烈反应,针筒活塞迅速
②实验3反应后甲针筒内有少量气体,检验该气体的操作及现象是:
操作:打开弹簧夹K,压缩活塞使气体慢慢导出,
③旋转甲.乙两个针筒,使中间导管口朝下,打开弹簧夹K,移动活塞,将实验3针筒中溶液压入滴有酚酞的20mL水中,溶液立即显
(2011?晋中三模)请回答下列问题:
(1)现代工业将煤炭气化,既可以提高燃料的利用率、减少CO、SO2等的排放,又可以扩大水煤气的广泛用途.
①已知:2C(s)+O2(g)=2CO(g);△H1,2H2(g)+O2(g)=2H2O(g);△H2.
则反应C(s)+H2O(g)?CO(g)+H2(g);△H=
.(用含△H1、△H2的代数式表示)
②CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g);△H3.现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2.
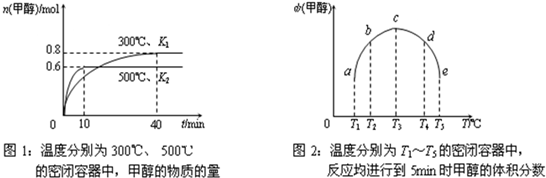
a.该反应的△H3
b.将容器d中的平衡状态转变到容器c中的平衡状态,可采取的措施有
(2)某燃料电池以熔融态K2CO3为电解质,一极通入CO,另一极通入空气和CO2的混合气体.已知该燃料电池正极反应为2CO2+O2+4e-=2CO32-;则其负极的电极反应式为
(3)图3为某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度变化情况.据图分析:
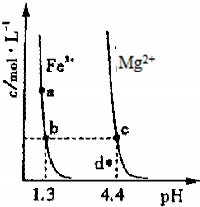
该温度下,溶度积常数的关系为:Ksp[Fe(OH)3]
(填:>、=、<);如果在新生成的Mg(OH)2浊液中滴入足量的Fe3+,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是
查看习题详情和答案>>
(1)现代工业将煤炭气化,既可以提高燃料的利用率、减少CO、SO2等的排放,又可以扩大水煤气的广泛用途.
①已知:2C(s)+O2(g)=2CO(g);△H1,2H2(g)+O2(g)=2H2O(g);△H2.
则反应C(s)+H2O(g)?CO(g)+H2(g);△H=
| △H1-△H 2 |
| 2 |
| △H1-△H 2 |
| 2 |
②CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g);△H3.现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2.

a.该反应的△H3
<
<
0(选填“<”、“>”或“=”,下同),K1>
>
K2.b.将容器d中的平衡状态转变到容器c中的平衡状态,可采取的措施有
升温、减压
升温、减压
.(2)某燃料电池以熔融态K2CO3为电解质,一极通入CO,另一极通入空气和CO2的混合气体.已知该燃料电池正极反应为2CO2+O2+4e-=2CO32-;则其负极的电极反应式为
CO+CO32--2e-=2CO2
CO+CO32--2e-=2CO2
.(3)图3为某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度变化情况.据图分析:

该温度下,溶度积常数的关系为:Ksp[Fe(OH)3]
<
<
Ksp[Mg(OH)2](填:>、=、<);如果在新生成的Mg(OH)2浊液中滴入足量的Fe3+,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是
由于Ksp[Fe(OH)3]<Ksp[Mg(OH)2],浊液中存在溶解平衡:Mg(OH)2?Mg2++2OH-,当加入Fe3+后与OH-生成更难溶解的Fe(OH)3,使平衡继续向右移动,最后Mg(OH)2全部溶解转化为红棕色的Fe(OH)3.
由于Ksp[Fe(OH)3]<Ksp[Mg(OH)2],浊液中存在溶解平衡:Mg(OH)2?Mg2++2OH-,当加入Fe3+后与OH-生成更难溶解的Fe(OH)3,使平衡继续向右移动,最后Mg(OH)2全部溶解转化为红棕色的Fe(OH)3.
.