摘要:本题由两部分组成 Ⅰ 通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱.也可用于估算化学反应的反应热(ΔH).化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差. 化学键 Si-O Si-Cl H-H H-Cl Si-Si Si-C O=O 键能/kJ·mol-1 460 360 436 431 176 347 498 请回答下列问题: (1)比较下列两组物质的熔点高低:?SiC Si,SiCl4 SiO2. (2)工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)Si 该反应的反应热ΔH= kJ·mol-1. (3)请把右图表示固体Si在O2中完全燃烧生成SiO2 固体的能量变化图补充完整. Ⅱ 某实验小组设计下列实验 A 分别配制250 mL 1.0 mol/L盐酸跟和250 mL 1.1 mol/L氢氧化钠溶液. B 每次分别取用上述配制的盐酸50 mL跟和氢氧化钠50 mL进行中和反应.并通过测定反应过程中所放出的热量可计算中和热.试回答下列问题: (1) 为进行A步实验时.有实验仪器托盘天平.药匙.小烧杯.玻璃棒.量筒.250mL容量瓶(2个).还缺少的仪器有 进行B步实验时.有实验仪器大烧杯.小烧杯.量筒(2个).小烧杯.塑料板.废纸条若干还缺少的实验仪器有 (2)在实验过程中.如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度.则测得 的△H (填“偏大 .“偏小 或“无影响 ), (3)该实验小组做了三次实验.每次取溶液各50 mL.并记录如下原始数据. 实验序号 起始温度t1/℃ 终止温度t2/℃ 温差(t2-t1) /℃ 盐酸 NaOH溶液 平均值 1 25.1 24.9 25.0 31.6 6.6 2 25.1 25.1 31.8 31.8 6.7 3 25.1 25.1 25.1 31.9 6.8 已知盐酸.NaOH溶液密度近似为1.00 g/cm3.中和后混合液的比热容C=4.18×10-3 kJ/,则该反应的热化学反应方程式为 .
网址:http://m.1010jiajiao.com/timu3_id_404581[举报]
 本题由两部分组成
本题由两部分组成Ⅰ通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.?
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C | O=O |
| 键能/kJ?mol-1 | 460 | 360 | 436 | 431 | 176 | 347 | 498 |
(1)比较下列两组物质的熔点高低(填“>”或“<”):SiC
>
>
Si;SiCl4<
<
SiO2.(2)工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)
| ||
+236
+236
kJ?mol-1.
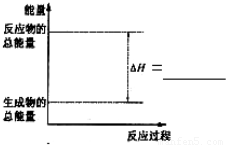
(3)请把如图表示固体Si在O2中完全燃烧生成SiO2固体的能量变化图补充完整.
Ⅱ某实验小组设计下列实验
A 分别配制250mL 1.0mol/L盐酸跟和250mL 1.1mol/L氢氧化钠溶液.
B 每次分别取用上述配制的盐酸50mL跟和氢氧化钠50mL进行中和反应,并通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:?
(1)为进行A步实验时,有实验仪器托盘天平、药匙、小烧杯、玻璃棒、量筒、
250mL容量瓶(2个),还缺少的仪器有
胶头滴管
胶头滴管
进行B步实验时,有实验仪器大烧杯、小烧杯、量筒(2个)、小烧杯、塑料板、废纸条若干还缺少的实验仪器有环形玻璃搅拌棒和温度计
环形玻璃搅拌棒和温度计
.(2)在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H
偏大
偏大
(填“偏大”、“偏小”或“无影响”);(3)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据.?
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1) /℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 31.8 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
HCl(aq)+NaOH(aq)=H2O(l)+NaCl(aq);△H=-56.01kJ/mol
HCl(aq)+NaOH(aq)=H2O(l)+NaCl(aq);△H=-56.01kJ/mol
.?
本题由两部分组成
Ⅰ通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.?
请回答下列问题:?
(1)比较下列两组物质的熔点高低(填“>”或“<”):SiC______Si;SiCl4______SiO2.
(2)工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g),该反应的反应热△H=______
Si(s)+4HCl(g),该反应的反应热△H=______
kJ?mol-1.
(3)请把如图表示固体Si在O2中完全燃烧生成SiO2固体的能量变化图补充完整.
Ⅱ某实验小组设计下列实验
A 分别配制250mL 1.0mol/L盐酸跟和250mL 1.1mol/L氢氧化钠溶液.
B 每次分别取用上述配制的盐酸50mL跟和氢氧化钠50mL进行中和反应,并通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:?
(1)为进行A步实验时,有实验仪器托盘天平、药匙、小烧杯、玻璃棒、量筒、
250mL容量瓶(2个),还缺少的仪器有______ 进行B步实验时,有实验仪器大烧杯、小烧杯、量筒(2个)、小烧杯、塑料板、废纸条若干还缺少的实验仪器有______.
(2)在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H______(填“偏大”、“偏小”或“无影响”);
(3)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据.?
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容C=4.18×10-3kJ/,则该反应的热化学反应方程式为______.?
 查看习题详情和答案>>
查看习题详情和答案>>
Ⅰ通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.?
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C | O=O |
| 键能/kJ?mol-1 | 460 | 360 | 436 | 431 | 176 | 347 | 498 |
(1)比较下列两组物质的熔点高低(填“>”或“<”):SiC______Si;SiCl4______SiO2.
(2)工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)
 Si(s)+4HCl(g),该反应的反应热△H=______
Si(s)+4HCl(g),该反应的反应热△H=______kJ?mol-1.
(3)请把如图表示固体Si在O2中完全燃烧生成SiO2固体的能量变化图补充完整.
Ⅱ某实验小组设计下列实验
A 分别配制250mL 1.0mol/L盐酸跟和250mL 1.1mol/L氢氧化钠溶液.
B 每次分别取用上述配制的盐酸50mL跟和氢氧化钠50mL进行中和反应,并通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:?
(1)为进行A步实验时,有实验仪器托盘天平、药匙、小烧杯、玻璃棒、量筒、
250mL容量瓶(2个),还缺少的仪器有______ 进行B步实验时,有实验仪器大烧杯、小烧杯、量筒(2个)、小烧杯、塑料板、废纸条若干还缺少的实验仪器有______.
(2)在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H______(填“偏大”、“偏小”或“无影响”);
(3)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据.?
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1) /℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 31.8 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
 查看习题详情和答案>>
查看习题详情和答案>>