摘要:16. (3)①浓硫酸 使滴和烧瓶中的SiHCl3气化 ②有固体物质生成 , 在反应温度下.普通玻璃会软化 , ③排尽装置中的空气 ④b d 解析:(1)高温用C还原SiO2生成CO而不是CO2. (2)分离.提纯不同沸点的液体可以采用分馏或蒸馏的方法. (3)用Zn.稀H2SO4制得的H2会混有少量H2O.而SiHCl3能与H2O剧烈反应.所以要进行干燥.根据装置选择液态干燥剂浓硫酸.C装置用水浴加热SiHCl3使其挥发成气体.和H2进入D装置反应.因为的温度很高.不能使用普通玻璃管.因为SiHCl3容易在空气中自燃.实验中还要注意先通一段时间H2排尽装置中的空气.
网址:http://m.1010jiajiao.com/timu3_id_404468[举报]
硫酸亚铁铵的化学式为(NH4)2Fe(SO4)2?6H2O,商品名为摩尔盐.硫酸亚铁可与硫酸铵生成硫酸亚铁铵,一般硫酸亚铁盐在空气中易被氧化,而形成摩尔盐后就比较稳定了.三种盐的溶解度(单位为g/100g水)如下表
实验室欲制备硫酸亚铁铵晶体,设计了如下方案.
(1)完成实验步骤中的填空:
①称取4g铁屑,放入小烧杯,加入15mL10%Na2CO3溶液,小火加热10min以除去
②将处理好的铁屑放入小烧杯,加入15mL 3mol/L H2SO4溶液,水浴加热至不再有气体生成为止,趁热过滤去剩余铁屑,并用少量热水洗涤烧杯及滤纸,并将滤液和洗涤液一起转移到蒸发皿中,则蒸发皿中溶液的溶质为
③加入
(2)回答下列问题:
①硫酸亚铁溶液在空气中易被氧化变质,操作时应注意:a
②加热、浓缩溶液时,不浓缩至干的理由是
③硫酸亚铁和硫酸铵的混合溶液加热浓缩就能得到硫酸亚铁铵晶体,其原因是
④称取两份质量均为1.96g的该硫酸亚铁铵,制成溶液.用未知浓度的KMnO4酸性溶液进行滴定.
Ⅰ) 滴定时,将KMnO4酸性溶液装在
Ⅱ) 已知MnO4-被还原为Mn2+,试写出该滴定过程中的离子方程式:
Ⅲ) 判断该反应到达滴定终点的现象为
Ⅳ) 假设到达滴定终点时,用去V mL KMnO4酸性溶液,则该KMnO4酸性溶液的浓度为
mol/L.
查看习题详情和答案>>
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4?7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2Fe(SO4)2?6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
(1)完成实验步骤中的填空:
①称取4g铁屑,放入小烧杯,加入15mL10%Na2CO3溶液,小火加热10min以除去
铁屑表面的油污
铁屑表面的油污
,倒掉溶液,用蒸馏水把铁冲洗干净,干燥,备用;②将处理好的铁屑放入小烧杯,加入15mL 3mol/L H2SO4溶液,水浴加热至不再有气体生成为止,趁热过滤去剩余铁屑,并用少量热水洗涤烧杯及滤纸,并将滤液和洗涤液一起转移到蒸发皿中,则蒸发皿中溶液的溶质为
硫酸亚铁
硫酸亚铁
(填名称,不考虑水解),其物质的量约为0.045
0.045
mol;③加入
5.94
5.94
g硫酸铵到蒸发皿中,缓缓加热、浓缩至表面出现结晶膜为止、冷却,得硫酸亚铁铵晶体.(2)回答下列问题:
①硫酸亚铁溶液在空气中易被氧化变质,操作时应注意:a
过滤洗涤操作速度要快
过滤洗涤操作速度要快
;b步骤③要缓缓加热,避免沸腾
步骤③要缓缓加热,避免沸腾
;②加热、浓缩溶液时,不浓缩至干的理由是
因为析出的是硫酸亚铁铵晶体,带有结晶水,蒸干会使晶体分解
因为析出的是硫酸亚铁铵晶体,带有结晶水,蒸干会使晶体分解
;③硫酸亚铁和硫酸铵的混合溶液加热浓缩就能得到硫酸亚铁铵晶体,其原因是
因为相同温度下硫酸亚铁铵晶体在水中的溶解度比硫酸亚铁和硫酸铵的溶解度小
因为相同温度下硫酸亚铁铵晶体在水中的溶解度比硫酸亚铁和硫酸铵的溶解度小
;④称取两份质量均为1.96g的该硫酸亚铁铵,制成溶液.用未知浓度的KMnO4酸性溶液进行滴定.
Ⅰ) 滴定时,将KMnO4酸性溶液装在
酸式
酸式
(酸式或碱式)滴定管,操作时用右
右
手拿锥形瓶;Ⅱ) 已知MnO4-被还原为Mn2+,试写出该滴定过程中的离子方程式:
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
;Ⅲ) 判断该反应到达滴定终点的现象为
当滴加最后一滴溶液后,溶液变成紫红色,30S内不褪色,说明达到滴定终点
当滴加最后一滴溶液后,溶液变成紫红色,30S内不褪色,说明达到滴定终点
;Ⅳ) 假设到达滴定终点时,用去V mL KMnO4酸性溶液,则该KMnO4酸性溶液的浓度为
| 1 |
| V |
| 1 |
| V |
(2012?闵行区二模)硫酸铜是一种应用广泛的化工原料.实验室中可将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1所示).

(1)配制质量分数20%的硫酸需要100mL 98%的浓硫酸(密度为1.84g/cm3)和
(2)图1中烧瓶中发生的离子反应方程式为
(3)图2是图1的改进装置,其优点有:①
为符合绿色化学的要求,某研究性学习小组进行了如下设计:
方案1:以空气为氧化剂.将铜粉在某仪器A中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.反应后,过滤、蒸发、结晶等,用少量95%的酒精淋洗后晾干,得CuSO4?5H2O晶体.
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向反应液中加Fe2(SO4)3,即发生反应.反应完全后向其中先后加入物质甲、物质乙,取样检验后,过滤、蒸发、结晶,滤渣可循环使用.[已知Fe(OH)2、Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为9.6、3.7和6.4.]
(4)方案l中的A仅器名称是
(5)方案2中物质甲可以是
a.Cu b.CuCO3 c.CuO d.氨水 e.氯水 f.双氧水
取样检验是为了确认Fe3+是否除净.有同学设计了以下两种方法:
方法①:取样于试管→滴加KSCN溶液;方法②:径向层析→喷KSCN溶液
指出你认为不合理的方法及存在的问题
(6)用铜粉制硫酸铜,上述方案1、方案2都不是十分理想,一种更符合绿色化学理念的是在氧气存在时用热稀硫酸与铜粉反应,其化学方程式是
查看习题详情和答案>>

(1)配制质量分数20%的硫酸需要100mL 98%的浓硫酸(密度为1.84g/cm3)和
717.6
717.6
mL蒸馏水.配制所需仪器除烧杯、量筒、胶头滴管外,还需要的仪器有玻璃棒
玻璃棒
.(2)图1中烧瓶中发生的离子反应方程式为
3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
.(3)图2是图1的改进装置,其优点有:①
防止倒吸
防止倒吸
;②有害气体能被完全吸收
有害气体能被完全吸收
.为符合绿色化学的要求,某研究性学习小组进行了如下设计:
方案1:以空气为氧化剂.将铜粉在某仪器A中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.反应后,过滤、蒸发、结晶等,用少量95%的酒精淋洗后晾干,得CuSO4?5H2O晶体.
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向反应液中加Fe2(SO4)3,即发生反应.反应完全后向其中先后加入物质甲、物质乙,取样检验后,过滤、蒸发、结晶,滤渣可循环使用.[已知Fe(OH)2、Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为9.6、3.7和6.4.]
(4)方案l中的A仅器名称是
坩埚
坩埚
.晶体采用酒精淋洗的优点是酒精与水互溶且极易挥发,减少晶体溶解
酒精与水互溶且极易挥发,减少晶体溶解
.(5)方案2中物质甲可以是
f
f
(选填答案编号,下同),物质乙可以是bc
bc
.a.Cu b.CuCO3 c.CuO d.氨水 e.氯水 f.双氧水
取样检验是为了确认Fe3+是否除净.有同学设计了以下两种方法:
方法①:取样于试管→滴加KSCN溶液;方法②:径向层析→喷KSCN溶液
指出你认为不合理的方法及存在的问题
方法①中Cu2+的蓝色对检验有干扰
方法①中Cu2+的蓝色对检验有干扰
.(6)用铜粉制硫酸铜,上述方案1、方案2都不是十分理想,一种更符合绿色化学理念的是在氧气存在时用热稀硫酸与铜粉反应,其化学方程式是
2Cu+O2+2H2SO4
2CuSO4+2H2O
| ||
2Cu+O2+2H2SO4
2CuSO4+2H2O
.
| ||
若配制500mL 0.2mol/L的稀硫酸:
(1)需要量取质量分数为98%的硫酸(密度为1.84g?mL-1)
(2)下面是某学生的操作过程:
a.检查容量瓶是否漏水;b.用100mL的量筒量取浓硫酸;
c.将浓硫酸倒入另一个盛有适量蒸馏水的量筒中稀释,并冷却到室温;
d.用玻璃棒引流,将稀释后的硫酸倒入500mL的容量瓶;
e.轻轻摇动容量瓶,使瓶内液体混合均匀,再向容量瓶中加水至离刻度线1cm~2cm;
f.用胶头滴管加水至凹液面底部与刻度线相切,摇匀;
g.在容量瓶上贴上标签待用.
按照通常的配制要求,指出其中缺少或操作的错误,并补充或改正(有几项填几项,若空格不够可以补加).
①
(3)任何实验都有误差,在你改正后的操作中,产生误差的原因还有
(4)本实验最浪费时间的步骤是将稀释后的硫酸冷却到室温,为了节约时间,简便易行的加快稀硫酸冷却的方法是
查看习题详情和答案>>
(1)需要量取质量分数为98%的硫酸(密度为1.84g?mL-1)
5.4
5.4
mL.(2)下面是某学生的操作过程:
a.检查容量瓶是否漏水;b.用100mL的量筒量取浓硫酸;
c.将浓硫酸倒入另一个盛有适量蒸馏水的量筒中稀释,并冷却到室温;
d.用玻璃棒引流,将稀释后的硫酸倒入500mL的容量瓶;
e.轻轻摇动容量瓶,使瓶内液体混合均匀,再向容量瓶中加水至离刻度线1cm~2cm;
f.用胶头滴管加水至凹液面底部与刻度线相切,摇匀;
g.在容量瓶上贴上标签待用.
按照通常的配制要求,指出其中缺少或操作的错误,并补充或改正(有几项填几项,若空格不够可以补加).
①
缺少洗涤烧杯和玻璃棒的操作
缺少洗涤烧杯和玻璃棒的操作
;②量筒的规格错,应该用10mL的量筒量取浓H2SO4
量筒的规格错,应该用10mL的量筒量取浓H2SO4
;③不应该在量筒中稀释浓H2SO4,应用烧杯
不应该在量筒中稀释浓H2SO4,应用烧杯
;④不应该用容量瓶保存溶液,应用细口瓶
不应该用容量瓶保存溶液,应用细口瓶
;⑤无
无
.(3)任何实验都有误差,在你改正后的操作中,产生误差的原因还有
量筒的精确度不够高、读数误差、溶质仍有少量残留在烧杯内、室温未必是20℃等
量筒的精确度不够高、读数误差、溶质仍有少量残留在烧杯内、室温未必是20℃等
.(4)本实验最浪费时间的步骤是将稀释后的硫酸冷却到室温,为了节约时间,简便易行的加快稀硫酸冷却的方法是
充分搅拌或给盛有稀H2SO4的烧杯敷冰块
充分搅拌或给盛有稀H2SO4的烧杯敷冰块
.实验小组测定某肥料中的总氮含量(以氮的质量分数表示) ,实验装置如下图(图中加热及夹持仪器略去):
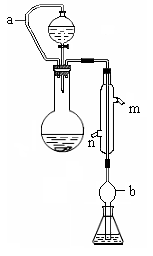
称取1.200 g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在碱性溶液中蒸馏氨,用25.00 mL浓度为0.5000 mol/L-1硫酸溶液充分吸收,再用浓度为0.1000 mol/L-1氢氧化钠溶液滴定未反应的硫酸。重复上述实验三次。实验数据如下:
| 实验次数 | 氢氧化钠溶液的体积 | |
| 滴定前刻度(mL) | 滴定后刻度(mL) | |
| 1 | 0.00 | 5. 01 |
| 2 | 6.00 | 10.99 |
| 3 | 12.00 | 17.60 |
(1)写出圆底烧瓶内发生反应的离子方程式 。
(2)分液漏斗和圆底烧瓶之间的导管a的作用是 ; b的作用是
;冷凝管中从(填“n”或“m”) 口进水。
(3)在滴定过程中,以下操作会使所测总氮含量偏小的是(填序号) 。
A.锥形瓶水洗后未烘干 B.滴定过程中滴定管有漏水现象
C.滴定过程中有少量溶液从锥形瓶中溅出 D.滴定前滴定管内有气泡,滴定后没有了
(4)若实验操作均正确,但测定结果偏低,可能造成该结果的主要原因是 。
(5)利用题目中所给数据计算肥料中总氮含量为 %(计算结果保留到小数点后1位)。
查看习题详情和答案>>甲学生急需3.0mol·L-1稀硫酸做探究性实验,而此时实验室只有18.4mol·L-1浓硫酸。请你为他配制100mL 3.0mol·L-1稀硫酸。
(1)建议配制过程如下:计算所需浓硫酸的体积是_________,量取浓硫酸所用的量筒的规格是______(从下列中选用A.10 mL B.25 mL C.50 mL D.100 mL),该量取过程还将用到的玻璃仪器有___________________________。稀释。具体操作过程是_______________________。待上步得到的稀释液充分冷却后,借助玻璃棒引流,注入_________________。用蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液也注入其中。轻轻摇动容量瓶,使溶液混合均匀。将蒸馏水注入容量瓶,待液面离容量瓶刻度线_________________,改用胶头滴管加水至液面与刻度线相切。盖好瓶塞,反复上下颠倒、摇匀。将配好的溶液转移到试剂瓶中,交甲同学使用。
(2)在配制溶液的过程中,你分别遭遇到下列情况之一时,甲同学将把“偏高”、“偏低”或“标准”的结论反馈给你:
A.所用的浓硫酸长时间放置在密封不好的容器中____________
B.容量瓶用蒸馏水洗涤后残留有少量的水____________
C.所用过的烧杯、玻璃棒未洗涤____________ ?
D.定容时俯视刻度线____________ ?
查看习题详情和答案>>
(1)建议配制过程如下:计算所需浓硫酸的体积是_________,量取浓硫酸所用的量筒的规格是______(从下列中选用A.10 mL B.25 mL C.50 mL D.100 mL),该量取过程还将用到的玻璃仪器有___________________________。稀释。具体操作过程是_______________________。待上步得到的稀释液充分冷却后,借助玻璃棒引流,注入_________________。用蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液也注入其中。轻轻摇动容量瓶,使溶液混合均匀。将蒸馏水注入容量瓶,待液面离容量瓶刻度线_________________,改用胶头滴管加水至液面与刻度线相切。盖好瓶塞,反复上下颠倒、摇匀。将配好的溶液转移到试剂瓶中,交甲同学使用。
(2)在配制溶液的过程中,你分别遭遇到下列情况之一时,甲同学将把“偏高”、“偏低”或“标准”的结论反馈给你:
A.所用的浓硫酸长时间放置在密封不好的容器中____________
B.容量瓶用蒸馏水洗涤后残留有少量的水____________
C.所用过的烧杯、玻璃棒未洗涤____________ ?
D.定容时俯视刻度线____________ ?