网址:http://m.1010jiajiao.com/timu3_id_402063[举报]
A. 浮于水面,熔成闪亮的小球,四边游动,逐渐缩小,溶液变红色
B. 产生大量的气体,气体可燃,溶液变浅红色
C. 反应+分剧烈,产生的气体可燃
D. 剧烈反应,产生的气体可燃
E. 生成白色胶状沉淀,继而沉淀消失
F. 生成淡黄色沉淀
(3)实验内容:
实验方案 实验现象 有关化学方程
(4)实验结论:________。
(5)问题讨论:①请从结构理论上简单说明上述结论的原因。
②请你补充一组实验方案(简单易行),证明此周期中另两种主族元素的性质递变规律。
现有下列短周期元素性质的数据:
元素编号
元素性质 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
原子半径
(10-10m) 0.74 1.60 1.52 1.10 0.99 1.86 0.75 0.82
最高和最
低化合价 +2 +1 +5 +7 +1 +5 +3
-2 -3 -1 -3
试回答下列问题:
(1)上述元素中处于同一主族的有________,元素②在周期表中的位置为________。
(2)上表中某两种元素,形成的分子中,每个原子都满足最外层为8电子的稳定结构,写出其电子式________。
(3)元素①⑥能形成两种化合物,写出其中较稳定的化,合物与水反应的,离子方程式:________。
查看习题详情和答案>>
用砂纸擦后的镁带丐沸水反应,再向反应后溶液中滴加酚酞溶液向新制的H2S饱和溶液中滴加新制的氯水钠与润滴有酚酞的冷水反应镁带与2mol·L-1盐酸反应铝条与2mol·L-1盐酸反应向ALCI3溶液中滴加NaOH溶液至过量
A. 浮于水面,熔成闪亮的小球,四边游动,逐渐缩小,溶液变红色
B. 产生大量的气体,气体可燃,溶液变浅红色
C. 反应+分剧烈,产生的气体可燃
D. 剧烈反应,产生的气体可燃
E. 生成白色胶状沉淀,继而沉淀消失
F. 生成淡黄色沉淀
(3)实验内容:
实验方案 实验现象 有关化学方程
(4)实验结论:________。
(5)问题讨论:①请从结构理论上简单说明上述结论的原因。
②请你补充一组实验方案(简单易行),证明此周期中另两种主族元素的性质递变规律。
现有下列短周期元素性质的数据:
元素编号
元素性质 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
原子半径
(10-10m) 0.74 1.60 1.52 1.10 0.99 1.86 0.75 0.82
最高和最
低化合价 +2 +1 +5 +7 +1 +5 +3
-2 -3 -1 -3
试回答下列问题:
(1)上述元素中处于同一主族的有________,元素②在周期表中的位置为________。
(2)上表中某两种元素,形成的分子中,每个原子都满足最外层为8电子的稳定结构,写出其电子式________。
(3)元素①⑥能形成两种化合物,写出其中较稳定的化,合物与水反应的,离子方程式:________。
查看习题详情和答案>>
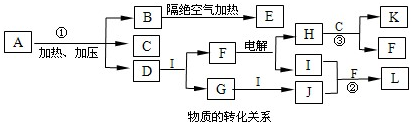
(1)A也是一种常用的肥料,其名称是
(2)反应①②③的化学方程式分别为
(3)I、B中M的质量分数为


II、已知氨分子的键角为107°18′,下列关于B的说法不正确的是
①含有不饱和碳原子,在一定条件下能发生加成反应
②能与盐酸反应生成盐
③在一定条件下能发生氧化反应
④分子中所有原子都在同一平面上
⑤在高温下分解放出N2,故可用作阻燃剂
⑥在一定条件下可与氢气发生加成反应
⑦含氮量低于A的含氮量
⑧它是一种极性化合物,易溶于甲醇、甲醛等有机物
⑨大量食用含B污染奶粉的婴幼儿会产生肾结石等泌尿系统疾病
⑩是白色粉末,有刺激性气味
(4)化合物E是一种新型无机材料,它的一种结构(β-X3M4)具有可与金刚石相媲美的硬度.请推测该材料可能的用途之一是
(5)液态D类似H2O,也能微弱电离且产生电子数相同的两种离子,则液态D电离方程式为
 NH4++NH2-
NH4++NH2- NH4++NH2-
NH4++NH2-(6)①在结构上N2H4和D的关系有如H2O2和H2O的关系.N2H4能发生下列反应:
N2H4+H3O+═N2H+5+H2O N2H4+H2O═N2H5++OH-
N2H5++H2O═N2H62++OH- N2H5++H2O═N2H4+H3O+
据此可得出的结论是
A.肼水解显酸性 B.肼在水中电离出H+离子
C.肼是二元弱碱 D.肼是二元弱酸
②发射“神舟七号”飞船的长征2号火箭用了肼(N2H4)作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水.已知4g N2H4(g)在上述反应中放出71kJ的热量,写出热化学方程式
A、B、R、D、E、F是六种原子序数依次增大的短周期元素, 其中有两种非金属元素位于同一主族。已知A、B、D均能与R形成原子(或离子)个数不同的几种常见化合物。请回答下列有关问题。
(1)仅由上述信息就可以确定的元素(写出代号与元素符号)是________________,若X、Y是D、F形成的最高价氧化物对应的水化物,浓度均为0.1mol/L的X、Y溶液的pH之和为14,则X、Y的晶体熔点相对高低为(写化学式)______ ______
(2) A与B、E均可形成正四面体构型的气态分子Q、P,又知P的燃烧热为1430kJ/mol,则其燃烧的热化学方程式___________ _________
(3) 上述六种元素间能形成多种常见二元化合物,其中存在两类化学键的物质的电子式为_____ __(写一种即可)
(4) R能形成多种单质,如R2、R3,研究表明,新近制得的一种组成为R4的分子中,每个R原子均与另外两个R原子各形成一个键,下列有关R4的说法中正确的是__ _____
①R4与R3、R2互为同位素 ②R4不能与A、B、D的单质反应
③R4中各原子最外电子层均为8电子结构 ④R4是一种新型化合物
查看习题详情和答案>>
A、B、R、D、E、F是六种原子序数依次增大的短周期元素, 其中有两种非金属元素位于同一主族。已知A、B、D均能与R形成原子(或离子)个数不同的几种常见化合物。请回答下列有关问题。
(1)仅由上述信息就可以确定的元素(写出代号与元素符号)是________________,若X、Y是D、F形成的最高价氧化物对应的水化物,浓度均为0.1mol/L的X、Y溶液的pH之和为14,则X、Y的晶体熔点相对高低为(写化学式)______ ______
(2) A与B、E均可形成正四面体构型的气态分子Q、P,又知P的燃烧热为1430kJ/mol,则其燃烧的热化学方程式___________ _________
(3) 上述六种元素间能形成多种常见二元化合物,其中存在两类化学键的物质的电子式为_____ __(写一种即可)
(4) R能形成多种单质,如R2、R3,研究表明,新近制得的一种组成为R4的分子中,每个R原子均与另外两个R原子各形成一个键,下列有关R4的说法中正确的是__ _____
①R4与R3、R2互为同位素 ②R4不能与A、B、D的单质反应
③R4中各原子最外电子层均为8电子结构 ④R4是一种新型化合物