摘要:25. 已知A.B.C.D和E 5种分子所含原子的数目依次为1.2.3.4和6.且都含有18个电子.又知B.C和D是由两种元素的原子组成.请回答: (1)组成A分子的原子的核外电子排布式是 , (2)B和C的分子式分别是 和 ,C分子的立体结构呈 形.该分子属于 分子, (3)若向D的稀溶液中加入少量二氧化锰.有无色气体生成.则D的分子式是 .该反应的化学方程式是 . (4)若将1 mol E在氧气中完全燃烧.只生成1 mol CO2和2 mol H2O.则E的分子式是 .
网址:http://m.1010jiajiao.com/timu3_id_401759[举报]
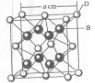
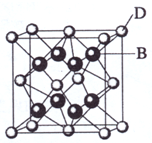 (2009?海南)已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图.
(2009?海南)已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图.请回答:
(1)A元素的名称是
氢
氢
;(2)B的元素符号是
F
F
,C的元素符号是Cl
Cl
,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是氟化氢分子间存在氢键,氯化氢分子间没有氢键
氟化氢分子间存在氢键,氯化氢分子间没有氢键
(3)E属元素周期表中第
四
四
周期,第VIIB
VIIB
族的元素,其元素名称是锰
锰
,它的+2价离子的电子排布式为1s22s22p63s23p63d5
1s22s22p63s23p63d5
:(4)从图中可以看出,D跟B形成的离子化合物的化学式为
CaF2
CaF2
;该离子化合物晶体的密度为a g?cm-3,则晶胞的体积是| 4×78g/mol |
| ag?cm-3×6.02×1023/mol |
| 4×78g/mol |
| ag?cm-3×6.02×1023/mol |
 已知A、B、C、D和E都是元素周期表中前20号的元素,它们的原子序数依次增大.A原子的价电子层的p轨道中只有1个电子;B、C、D元素的基态原子具有相同的能层数,B、D元素的原子的p能级上都有1个未成对电子,D原子得一个电子填入3p轨道后,3p轨道已充满,C原子的p轨道中有3个未成对电子;E是同周期第一电离能最小的元素.回答下列问题:
已知A、B、C、D和E都是元素周期表中前20号的元素,它们的原子序数依次增大.A原子的价电子层的p轨道中只有1个电子;B、C、D元素的基态原子具有相同的能层数,B、D元素的原子的p能级上都有1个未成对电子,D原子得一个电子填入3p轨道后,3p轨道已充满,C原子的p轨道中有3个未成对电子;E是同周期第一电离能最小的元素.回答下列问题:(1)写出下列元素的符号:A
B
B
、BAl
Al
、CP
P
;(2)上述五种元素中最高价氧化物对应水化物酸性最强的是
HClO4
HClO4
,(填写化学式)碱性最强的是

(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
Cl
Cl
,电负性最大的元素是Cl
Cl
;(4)在AD3分子中A元素原子的原子轨道发生的是
sp2
sp2
杂化,分子空间构型为平面三角形
平面三角形
;(5)将B 的单质投入E的最高价氧化物对应水化物中,发生反应生成物中有此离子[B(OH)4]-离子方程式是
2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑
2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑
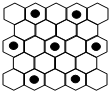
.(6)石墨具有平面层状结构,同一层中的原子构成许许多多的正六边形,它与熔融的E单质相互作用,形成某种青铜色的物质(其中的元素E用“●”表示),原子分布如图所示,该物质的化学式为
KC8
KC8
.
原子数相同、电子总数相同的分子,互称为等电子体.
Ⅰ.已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、6和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1:2.
请回答:
(1)组成A分子的原子的元素符号是 ;已知E是有毒的有机物,E的熔、沸点比CH4的熔、沸点高,其主要原因是 .
(2)C的立体结构呈 形,该分子属于 分子(填“极性”或“非极性”);
(3)火箭中可充入四氧化二氮和D作为燃料反应生成氮气和水,该反应的化学方程式为 .(不需要写反应条件)
Ⅱ.CO与N2互为等电子体.
(4)CO的总键能大于N2的总键能,但CO比N2容易参加化学反应.
根据下表数据,说明CO比N2活泼的原因是 .
(5)它们的分子中都包含 个σ键, 个π键.
(6)Fe、Co、Ni等金属能与CO反应的原因与这些金属原子的电子层结构有关.
Ni原子的价电子排布式为 .Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类型);Fe(CO)5是配合物,配体是 .
查看习题详情和答案>>
Ⅰ.已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、6和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1:2.
请回答:
(1)组成A分子的原子的元素符号是
(2)C的立体结构呈
(3)火箭中可充入四氧化二氮和D作为燃料反应生成氮气和水,该反应的化学方程式为
Ⅱ.CO与N2互为等电子体.
(4)CO的总键能大于N2的总键能,但CO比N2容易参加化学反应.
根据下表数据,说明CO比N2活泼的原因是
| A-B | A=B | A≡B | ||
| CO | 键能(kJ/mol) | 357.7 | 798.9 | 1071.9 |
| 键能差值(kJ/mol) | 441.2 273 | |||
| N2 | 键能(kJ/mol) | 154.8 | 418.4 | 941.7 |
| 键能差值(kJ/mol) | 263.6 523.3 | |||
(6)Fe、Co、Ni等金属能与CO反应的原因与这些金属原子的电子层结构有关.
Ni原子的价电子排布式为
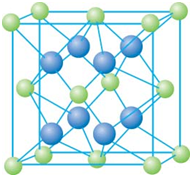 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B形成的晶体其晶胞结构如图,图中小球代表D,大球代表B.请回答:
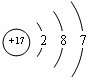
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B形成的晶体其晶胞结构如图,图中小球代表D,大球代表B.请回答:(1)A元素的名称是
氢
氢
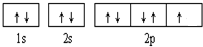
;(2)B元素的轨道表示式是


氟化氢分子间存在氢键,氯化氢分子间没有氢键
氟化氢分子间存在氢键,氯化氢分子间没有氢键
;(3)E属于元素周期表中第
四
四
周期,第VIIB
VIIB
族的元素,其元素名称是锰
锰
;属于元素周期表中的d
d
区(填元素分区),它的+2价离子的电子排布式为1s22s22p63s23p63d5
1s22s22p63s23p63d5
;(4)从图中可以看出,D跟B形成的离子化合物的化学式为
CaF2
CaF2
;该离子化合物晶体的密度为a g?cm-3,则晶胞的体积是| 4×78g/mol |
| ag/cm3×6.02×1023/mol |
| 4×78g/mol |
| ag/cm3×6.02×1023/mol |
 (2011?开封一模)[化学--选修物质结构与性质]
(2011?开封一模)[化学--选修物质结构与性质]已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B原子的L层p轨道中有5个电子;C是周期表中1-18列中的第14列元素;D和E属同一周期,又知E原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1,D跟B可形成离子化合物,其晶胞结构如图.请回答:
(1)A与c形成的共价化合物的分子式是
SiH4
SiH4
,杂化轨道是sp3
sp3
,分子的立体结构是正四面体
正四面体
.(2)B与C比较,电负性较小的是
Si
Si
(填元素符号);B与c形成的化合物晶体类型是分子晶体
分子晶体
. (3)E属元素周期表中第
四
四
周期,第ⅡB
ⅡB
族的元素,其元素名称是锌
锌
,它的+2价离子的电子排布式为1s22s22p63s2sp63d10
1s22s22p63s2sp63d10
.(4)从图中可以看出,D踉B形成的离子化合物的化学式为
CaF2
CaF2
;若设该晶胞的边长为a cm,则该离子化合物晶体的密度是| 4×78/mol |
| a3cm3?6.02×1023mol-1 |
| 4×78/mol |
| a3cm3?6.02×1023mol-1 |