摘要:1.环境:
网址:http://m.1010jiajiao.com/timu3_id_40134[举报]
环境和材料是现在社会中两大关注的问题,请回答:
(1)室内空气污染物主要包括CO、CO2、HCHO(甲醛)、C6H6(苯)等,在这四种污染物中,由建筑和装修产生的是
(2)造成水体富营养化的主要原因是
A.汞(Hg)、镉(Cd) B.N、P的化合物
C.石油泄漏 D.工厂排放酸、碱、盐
(3)造成白色污染的主要原因是
A.废塑料制品 B.废铝制易拉罐
B.废旧电池 D.生活垃圾
(4)为了治理汽车尾气的污染问题,可以在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂).它的特点是使CO与NO反应,生成CO2和N2,写出该反应的化学方程式:
(5)合金是被广泛应用的金属材料,下列有关合金性质的说法正确的是
A.合金的熔点一般比它的成分金属高
B.合金的硬度一般比它的成分金属低
C.组成合金的元素种类相同,合金的性能就一定相同
D.合金与各成分金属相比,具有许多优良的物理、化学或机械性能
(6)塑料、合成橡胶和
查看习题详情和答案>>
(1)室内空气污染物主要包括CO、CO2、HCHO(甲醛)、C6H6(苯)等,在这四种污染物中,由建筑和装修产生的是
HCHO(甲醛)、C6H6(苯)
HCHO(甲醛)、C6H6(苯)
.(2)造成水体富营养化的主要原因是
B
B
.A.汞(Hg)、镉(Cd) B.N、P的化合物
C.石油泄漏 D.工厂排放酸、碱、盐
(3)造成白色污染的主要原因是
A
A
.A.废塑料制品 B.废铝制易拉罐
B.废旧电池 D.生活垃圾
(4)为了治理汽车尾气的污染问题,可以在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂).它的特点是使CO与NO反应,生成CO2和N2,写出该反应的化学方程式:
2NO+CO
CO2+N2
| ||
2NO+CO
CO2+N2
.
| ||
(5)合金是被广泛应用的金属材料,下列有关合金性质的说法正确的是
D
D
(填字母).A.合金的熔点一般比它的成分金属高
B.合金的硬度一般比它的成分金属低
C.组成合金的元素种类相同,合金的性能就一定相同
D.合金与各成分金属相比,具有许多优良的物理、化学或机械性能
(6)塑料、合成橡胶和
合成纤维
合成纤维
是常说的三大合成材料.环境污染已经成为社会面临的重大威胁,下列名词都与环境污染有关:①:白色垃圾;②:光化学烟雾;③:重金属污染;④:水华与赤潮;⑤:臭氧空洞;⑥:酸雨.(填序号)
(1)大量使用聚乙烯制品造成污染的是
(2)二氧化氮在空气中带来的两种污染是
(3)富含氮磷元素的污水造成的污染是
(4)铅、汞、铜造成的污染成为
查看习题详情和答案>>
(1)大量使用聚乙烯制品造成污染的是
①
①
(2)二氧化氮在空气中带来的两种污染是
②⑥
②⑥
(3)富含氮磷元素的污水造成的污染是
④
④
(4)铅、汞、铜造成的污染成为
③
③
. 环境保护是目前人类面临的一项重大课题.为应对燃料使用造成的环境污染,科学家构想了利用太阳能促进燃料的循环使用,其构想可用如图表示:
环境保护是目前人类面临的一项重大课题.为应对燃料使用造成的环境污染,科学家构想了利用太阳能促进燃料的循环使用,其构想可用如图表示:其中主要的反应为:
①2CO2
| ||
②2H2O
| ||
③2N2+6H2O
| ||
④2CO2+4H2O
| 光能 |
⑤
CO2
CO2
+H2O| 光能 |
2O2
2O2
.请你填空:
(1)请你将反应⑤补充完整:
CO2
CO2
+H2O| 光能 |
2O2
2O2
(2)过程Ⅱ中的△H
<
<
0(填“<”、“>”或“=”).(3)下列对过程Ⅰ和Ⅱ的描述中正确的是
bd
bd
.a.太阳能最终转化为化学能贮存于化学物质中
b.太阳能最终主要转化为热能
c.经过上述一个循环后放出O2
d.经过上述一个循环后不会产生新物质
(4)要实现上述循环,当前需要解决的关键问题是过程
Ⅰ
Ⅰ
(填“Ⅰ”或“Ⅱ”),此过程的设计可参考自然界中光合
光合
作用.(5)用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移电子的物质的量为
1.6mol
1.6mol
,试写出上述NO2转化为N2的热化学方程式:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ?mol-1
CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ?mol-1
. 环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素.
环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素.(1)CO的中毒是由于CO与血液中血红蛋白的血红素部分反应生成碳氧血红蛋白,反应方程式可表示为:CO+Hb?O2
 O2+Hb?CO
O2+Hb?CO实验表明,c(Hb?CO)即使只有c(Hb?O2)的 1/50,也可造成人的智力损伤.
已知t℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2mol?L-1,若使c(Hb?CO)小于c(Hb?O2)的 1/50,则吸入肺部CO的浓度不能超过
1.0×10-6
1.0×10-6
mol?L-1.(2)汽车尾气治理的方法之一是在汽车的排气管上安装一个“催化转化器”.
已知反应2NO(g)+2CO(g)
 N2(g)+2CO2(g)△H=-113kJ?mol-1
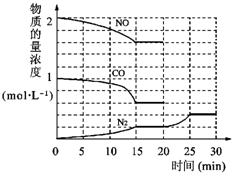
N2(g)+2CO2(g)△H=-113kJ?mol-1①为了模拟催化转化器的工作原理,在t℃时,将2molNO与1mol CO充入lL反应容器中,反应过程中NO(g)、CO(g)、N2(g)物质的量浓度变化如右下图所示.反应进行到15min时,NO的平均反应速率为
| 0.4 |
| 15 |
| 0.4 |
| 15 |
②观察在20min~30min内N2(g)发生变化的曲线图,判断引起该变化的条件可能是
b
b
;a.加入催化剂
b.降低体系温度
c.缩小容器体积为0.5L
d.增加CO2的物质的量
(3)煤化工中常需研究不同温度下平衡常数、投料比及产率等问题.
已知:CO(g)+H2O(g)
 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
①上述正向反应是:
放热
放热
反应(填“放热”、“吸热”).②某温度下上述反应平衡时,恒容、升高温度,正反应速率
增大
增大
(填“增大”、“减小”或“不变”),容器内混合气体的压强增大
增大
(填“增大”、“减小”或“不变”).③在830℃发生上述反应,以下表中的物质的量投入恒容反应器,其中向正反应方向移动的有
B、C
B、C
(选填A、B、C、D).| A | B | C | D | |
| n(CO2) | 3 | 1 | 0 | 1 |
| n(H2) | 2 | 1 | 0 | 1 |
| n(CO) | 1 | 2 | 3 | 0.5 |
| n(H2O) | 5 | 2 | 3 | 2 |
 环境中常见的重金属污染有:汞、铅、锰、铬、镉.处理工业废水中常含有的Cr2O72-和CrO
环境中常见的重金属污染有:汞、铅、锰、铬、镉.处理工业废水中常含有的Cr2O72-和CrO2- 4 |
方法1:还原沉淀法
该法的工艺流程为:
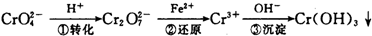
其中第①步存在平衡:2CrO
2- 4 |
2- 7 |
(1)写出第①步反应的平衡常数表达式
(2)关于第①步反应,下列说法正确的是
A.通过测定溶液的pH值可以判断反应是否已达平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1mol Cr2O
2- 3 |
(4)第③步除生成的Cr(OH)3,还可能生成的沉淀为
Cr(OH)3(s)?Cr3+(aq)+3OH(aq),常温下,Cr(OH)3的溶度积K sp=10-32,当c(Cr3+)降至10-5 mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)
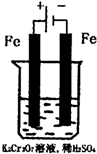
方法2:电解法
(5)实验室利用如图装置模拟电解法处理含Cr2O
2- 3 |