摘要:21.如右图已知: ①单质E可作为半导体材料, ②化合物F是不能生成盐的氧化物, ③化合物I能溶于水呈酸性.它能 够与化合物A反应.据此.请填空: (1)化合物F的化学式为 . (2)化合物I的名称是 . (3)反应③的化学方程式为 . (4)反应④的化学方程式为 .
网址:http://m.1010jiajiao.com/timu3_id_401279[举报]
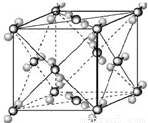
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外电子层的p能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.
试回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)基态Ga原子的核外电子排布式为______.
(2)A、B、C的第一电离能由大到小的顺序为______.
(3)B元素的单质分子中有______个π键,与其互为等电子体的物质的化学式可能为______(任写一种).
(4)上述A的氧化物分子的中心原子采取______杂化,其晶胞中微粒间的作用力为______.
(5)EH3分子的空间构型为______,其沸点与BH3相比______(填“高”或“低”),原因是______.
(6)向CuSO4溶液中逐滴加入BH3的水溶液,得到深蓝色的透明溶液.请写出该反应的离子方程式______.
 查看习题详情和答案>>
查看习题详情和答案>>
试回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)基态Ga原子的核外电子排布式为______.
(2)A、B、C的第一电离能由大到小的顺序为______.
(3)B元素的单质分子中有______个π键,与其互为等电子体的物质的化学式可能为______(任写一种).
(4)上述A的氧化物分子的中心原子采取______杂化,其晶胞中微粒间的作用力为______.
(5)EH3分子的空间构型为______,其沸点与BH3相比______(填“高”或“低”),原因是______.
(6)向CuSO4溶液中逐滴加入BH3的水溶液,得到深蓝色的透明溶液.请写出该反应的离子方程式______.
 查看习题详情和答案>>
查看习题详情和答案>>
 (10分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。其中B、D、F原子最外电子层的P能级(轨道)上的电子处于半满状态。通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示。E的电负性在该周期中最大。镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaF为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料。
(10分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。其中B、D、F原子最外电子层的P能级(轨道)上的电子处于半满状态。通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示。E的电负性在该周期中最大。镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaF为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料。
试回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
(1)基态Ga原子的核外电子排布式为 。
(2)A、B、C的第一电离能由大到小的顺序为 。
(3)B元素的单质分子中有 个π键。
(4)上述A的氧化物分子中心原子采取______杂化,其晶胞中微粒间的作用力为 。
(5)FH3沸点与比BH3 (填“高”或“低”),原因是 。
(6)固体CrE3?6H2O溶于水可能有几种不同组成的配离子,实验将含0.2665gCrE3?6H2O的溶液通过H-离子交换树脂(只交换配阳离子),交换出的酸用0.125mol/L的氢氧化钠溶液8.00mL中和。已知配离子配位数为6,则该配离子是
查看习题详情和答案>>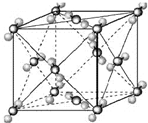 (2009?宿迁模拟)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外电子层的p能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.
(2009?宿迁模拟)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外电子层的p能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.试回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)基态Ga原子的核外电子排布式为
1s22s22p63s23p63d104s24p1
1s22s22p63s23p63d104s24p1
.(2)A、B、C的第一电离能由大到小的顺序为
N>C>Si
N>C>Si
.(3)B元素的单质分子中有
2
2
个π键,与其互为等电子体的物质的化学式可能为CO(或其他合理答案)
CO(或其他合理答案)
(任写一种).(4)上述A的氧化物分子的中心原子采取
sp
sp
杂化,其晶胞中微粒间的作用力为范德华力
范德华力
.(5)EH3分子的空间构型为
三角锥形
三角锥形
,其沸点与BH3相比低
低
(填“高”或“低”),原因是NH3分子间能形成氢键,AsH3分子间不能形成氢键
NH3分子间能形成氢键,AsH3分子间不能形成氢键
.(6)向CuSO4溶液中逐滴加入BH3的水溶液,得到深蓝色的透明溶液.请写出该反应的离子方程式
Cu2++2NH3?H2O=Cu(OH)2+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
Cu2++2NH3?H2O=Cu(OH)2+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
.