网址:http://m.1010jiajiao.com/timu3_id_39865[举报]
下列说法中错误的是( )
A.元素周期表有7个主族7个副族 B.稀有气体元素原子的最外层电子均为8
C.氢是原子半径最小的元素 D. 氧元素位于第2周期ⅥA族
【解析】稀有气体元素He的最外层只有2个电子,B是错误的,所以答案选B。
查看习题详情和答案>>
下列说法中错误的是( )
A.元素周期表有7个主族7个副族 B.稀有气体元素原子的最外层电子均为8
C.氢是原子半径最小的元素 D. 氧元素位于第2周期ⅥA族
【解析】稀有气体元素He的最外层只有2个电子,B是错误的,所以答案选B。
查看习题详情和答案>>
(10分)A、B、C、D四种元素的原子序数均小于18,其最高正价数依次为1,4,5,7,已知B的原子核外次外层电子数为2。A、C原子的核外次外层电子数为8。D元素的最高价氧化物对应的水化物是已知含氧酸中最强酸,则:
(1)A的离子结构示意图是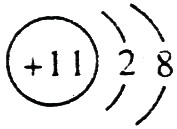 ,C的原子结构示意图是
,C的原子结构示意图是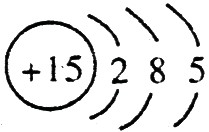 。
。
(2)C的最高价氧化物对应的水化物与A的氢氧化物生成三种盐,化学式分别为Na3PO4、Na2HPO4、NaH2PO4。
(3)C、D的气态氢化物稳定性由强到弱的顺序是 HCl>PH3。
【解析】 最高正价=原子最外层电子数,B元素的原子最外层电子数应为4,B元素原子的次外层电子数为2,为K层,B元素原子核外共有2+4=6个电子,B是6号元素碳;A、C原子次外层电子数为8,则A、C原子核外电子数分别是:2+8+1=11和2+8+5=15,所以A为11号元素钠,C为15号元素磷;在1~18号元素中,最高价为+7的只有氯元素(F无正价),而HClO4是已知含氧酸中最强的酸,故D为氯。
(1)钠总是+1价,其离子结构示意图为: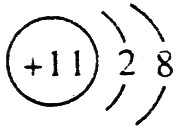 ;磷的原子序数是15,其原子结构示意图是:
;磷的原子序数是15,其原子结构示意图是: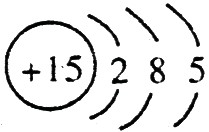 。
。
(2)磷的最高价(+5)氧化物对应的水化物是H3PO4,与NaOH反应生成:Na3PO4、NaH2PO4三种盐。
(3)P、Cl原子都具有3个电子层,核电荷数P(15)小于Cl(17),原子半径r(P)>r(Cl),所以非金属Cl>P,气态氢化物稳定性HCl>PH3。
查看习题详情和答案>>