网址:http://m.1010jiajiao.com/timu3_id_3971893[举报]
KMnO4的制取:
实验室制取KMnO4的方法和步骤是①高温灼烧MnO2、KOH等获得K2MnO4固体②用适量热蒸馏水溶解K2MnO4③加热K2MnO4溶液并缓慢通入CO2,反应生成KMnO4、K2CO3和MnO2④悬浊液经过滤,…,低温烘干,最终制得高锰酸钾晶体.
(1)步骤②中用热蒸馏水溶解的目的是
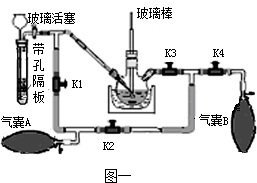
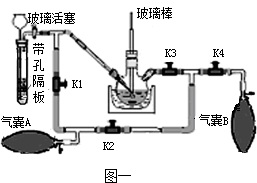
(2)带孔隔板上的块状固体是
(3)实验操作是先打开K3、K2,关闭K1、K4,稍打开玻璃活塞,缓慢 通入CO2,未反应的CO2被气囊A收集.一段时间后,关闭玻璃活塞,打开K1、K3、K4,关闭K2,缓慢挤压气囊A将CO2排到反应液中,未反应的CO2被气囊B收集,打开K1、K2、
(4)该实验设计的优点是
KMnO4含量测定:
(5)利用高锰酸钾加热分解测定样品中KMnO4的质量分数,应选择装置A和装置
(6)实验步骤:精确称量一定质量高锰酸钾样品;点燃酒精灯加热;当
(7)若量筒的规格是100mL,O2的密度为1.420g/L,则KMnO4样品最多称取
(8)若KMnO4样品质量为1g,测得O2体积为56.3mL.计算样品KMnO4的含量(O2的质量保留两位小数,写出计算过程,).
(9)若测定的KMnO4样品纯度偏大,其原因可能是
高锰酸钾可以杀灭细菌,是家庭必备的常用消毒药.已知:K2MnO4溶液为绿色溶液.
KMnO4的制取:
实验室制取KMnO4的方法和步骤是①高温灼烧MnO2、KOH等获得K2MnO4固体②用适量热蒸馏水溶解K2MnO4③加热K2MnO4溶液并缓慢通入CO2,反应生成KMnO4、K2CO3和MnO2④悬浊液经过滤,…,低温烘干,最终制得高锰酸钾晶体.
(1)步骤②中用热蒸馏水溶解的目的是________,步骤③中获取KMnO4的化学方程式是________.步骤④中高锰酸钾晶体只能低温烘干的原因是________.
(2)带孔隔板上的块状固体是________,从长颈漏斗中加入的溶液是________.
(3)实验操作是先打开K3、K2,关闭K1、K4,稍打开玻璃活塞,缓慢 通入CO2,未反应的CO2被气囊A收集.一段时间后,关闭玻璃活塞,打开K1、K3、K4,关闭K2,缓慢挤压气囊A将CO2排到反应液中,未反应的CO2被气囊B收集,打开K1、K2、________,关闭________,缓慢挤压气囊B,这样往复进行上述操作.当用玻璃棒蘸取溶液点在滤纸上,只有________色,说明反应完全.
(4)该实验设计的优点是________.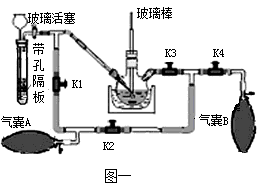
KMnO4含量测定:
(5)利用高锰酸钾加热分解测定样品中KMnO4的质量分数,应选择装置A和装置________组合(固定装置略),试管口塞有棉花团的作用是________.
(6)实验步骤:精确称量一定质量高锰酸钾样品;点燃酒精灯加热;当________时,收集气体;________酒精灯,冷却后调节量筒高度,并使量筒内外液面相平,读取气体体积.
(7)若量筒的规格是100mL,O2的密度为1.420g/L,则KMnO4样品最多称取________g(保留两位小数).
(8)若KMnO4样品质量为1g,测得O2体积为56.3mL.计算样品KMnO4的含量(O2的质量保留两位小数,写出计算过程,).
(9)若测定的KMnO4样品纯度偏大,其原因可能是________.
查看习题详情和答案>>
KMnO4的制取:
实验室制取KMnO4的方法和步骤是①高温灼烧MnO2、KOH等获得K2MnO4固体②用适量热蒸馏水溶解K2MnO4③加热K2MnO4溶液并缓慢通入CO2,反应生成KMnO4、K2CO3和MnO2④悬浊液经过滤,…,低温烘干,最终制得高锰酸钾晶体.
(1)步骤②中用热蒸馏水溶解的目的是______,步骤③中获取KMnO4的化学方程式是______.步骤④中高锰酸钾晶体只能低温烘干的原因是______.
(2)带孔隔板上的块状固体是______,从长颈漏斗中加入的溶液是______.
(3)实验操作是先打开K3、K2,关闭K1、K4,稍打开玻璃活塞,缓慢 通入CO2,未反应的CO2被气囊A收集.一段时间后,关闭玻璃活塞,打开K1、K3、K4,关闭K2,缓慢挤压气囊A将CO2排到反应液中,未反应的CO2被气囊B收集,打开K1、K2、______,关闭______,缓慢挤压气囊B,这样往复进行上述操作.当用玻璃棒蘸取溶液点在滤纸上,只有______色,说明反应完全.
(4)该实验设计的优点是______.
KMnO4含量测定:
(5)利用高锰酸钾加热分解测定样品中KMnO4的质量分数,应选择装置A和装置______组合(固定装置略),试管口塞有棉花团的作用是______.
(6)实验步骤:精确称量一定质量高锰酸钾样品;点燃酒精灯加热;当______时,收集气体;______酒精灯,冷却后调节量筒高度,并使量筒内外液面相平,读取气体体积.
(7)若量筒的规格是100mL,O2的密度为1.420g/L,则KMnO4样品最多称取______g(保留两位小数).
(8)若KMnO4样品质量为1g,测得O2体积为56.3mL.计算样品KMnO4的含量(O2的质量保留两位小数,写出计算过程,).
(9)若测定的KMnO4样品纯度偏大,其原因可能是______.
高锰酸钾可以杀灭细菌,是家庭必备的常用消毒药.
已知:K2MnO4溶液为绿色溶液.
KMnO4的制取:实验室制取KMnO4的方法和步骤是①高温灼烧MnO2、KOH等获得K2MnO4固体②用适量热蒸馏水溶解K2MnO4③加热K2MnO4溶液并缓慢通入CO2,反应生成KMnO4、K2CO3和MnO2④悬浊液经过滤,…,低温烘干,最终制得高锰酸钾晶体.
(1)步骤②中用热蒸馏水溶解的目的是________,步骤③中获取KMnO4的化学方程式是________.步骤④中高锰酸钾晶体只能低温烘干的原因是________.
(2)带孔隔板上的块状固体是________,从长颈漏斗中加入的溶液是________.
(3)实验操作是先打开K3、K2,关闭K1、K4,稍打开玻璃活塞,缓慢通入CO2.,未反应的CO2被气囊A收集.一段时间后,关闭玻璃活塞,打开K1、K3、K4,关闭K2,缓慢挤压气囊A将CO2排到反应液中,未反应的CO2被气囊B收集,打开K1、K2、________,关闭________,缓慢挤压气囊B,这样往复进行上述操作.当用玻璃棒蘸取溶液点在滤纸上,只有________色,说明反应完全.
(4)该实验设计的优点是________.

KMnO4含量测定:
(5)利用高锰酸钾加热分解测定样品中KMnO4的质量分数,应选择装置A和装置________组合(固定装置略),试管口塞有棉花团的作用是________.
(6)实验步骤:精确称量一定质量高锰酸钾样品;点燃酒精灯加热;当________时,收集气体;________酒精灯,冷却后调节量筒高度,并使量筒内外液面相平,读取气体体积.
(7)若量筒的规格是100 mL,O2的密度为1.420 g/L,则KMnO4样品最多称取________g(保留两位小数).
(8)若KMnO4样品质量为1 g,测得O2体积为56.3 mL.计算样品KMnO4的含量(O2的质量保留两位小数,写出计算过程,3分).
(9)若测定的KMnO4样品纯度偏大,其原因可能是________.
根据高锰酸钾(KMnO4)制取氧气的实验探究,结合下图回答问题。

[反应原理]
加热高锰酸钾制取氧气的化学方程式为——。
[仪器装置]
(1)写出标有序号的仪器名称:①———————,②——;
(2)应选用的气体发生装置为——(选填字母序号,下同),气体收集装置为——。
[问题探究]
实验中,有同学发现对药品加热一段时间后收集不到氧气,可能的原因是——
[实验反思]
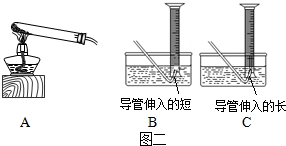
(1)在清洗试管中的反应残留物时,有的同学发现水溶液出现紫红色,有的发现水溶液呈墨绿色(锰酸钾溶于水所致),且同时有黑色的粉末状固体。你对水溶液出现紫红色这一现象的解释是—— 。
为了分离、回收反应残留物中的黑色粉末状固体,需对混合物溶液进行过滤。过滤操作时,需将圆形滤纸折叠。下列滤纸折叠过程图示中,正确的是 (选填“甲”或“乙” )。

(2)有同学发现,不慎将高锰酸钾粘到了手上,会留下一时洗不掉的褐色斑痕。老师说,这是高锰酸钾氧化作用对皮肤的腐蚀所致。
针对这个案例,在实验前你想提醒同学们注意的是——。
[课外延伸]
一同学上网查阅,知道高锰酸钾还有其他用途。如用板材装修的新房内,往往有一股刺鼻的气味,这是室内污染的主要成分之一甲醛引起。可用列反应来测定甲醛(用R表示)含量是否超标:
![]()
试确定R的化学式——。
查看习题详情和答案>>