摘要:某元素原子A的质子数为Z.已知B3+和A2-具有相同的核外电子数.则B元素原 子的质子数为 ( ) A.Z-2+3 B.Z-2-3 C.Z+2+3 D.Z+2-3
网址:http://m.1010jiajiao.com/timu3_id_3968869[举报]
已知:①A、B、C、D四种物质均含有元素X,可能还含有元素Y或Z.元素Y、X、Z的原子序数依次递增且不超过20.②X在A、B、C、D中的化合价分别为0、-1、+1、+5.③室温下单质A与某种常见一元强碱溶液反应,可得到B和C.④化合物D在二氧化锰催化下受热分解,可制得元素Y的单质.请回答下列问题:
(1)写出元素X、Y、Z的元素符号:X:
(2)写出A、B、C、D的化学式:A
(3)画出Y原子的结构示意图
 ;写出③中反应的化学方程式
;写出③中反应的化学方程式
(4)写出④中反应的化学方程式
(5)制得元素Y的单质,若收集到标准状况下6.72LY单质气体,至少需要多少克化合物D?同时生成氯化物的物质的量为多少mol?(用涉及到的化学式写出计算步骤)
查看习题详情和答案>>
(1)写出元素X、Y、Z的元素符号:X:
Cl
Cl
,Y:O
O
,ZK
K
.(2)写出A、B、C、D的化学式:A
Cl2
Cl2
,BNaCl
NaCl
,CNaClO
NaClO
,DKClO3
KClO3
.(3)画出Y原子的结构示意图


Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+2NaOH=NaCl+NaClO+H2O
.(4)写出④中反应的化学方程式
2KClO3
2KCl+3O2 ↑
| ||
| △ |
2KClO3
2KCl+3O2 ↑
.实验室通过反应④制得元素Y的单质后,如何将产物分离并分别获得纯净物?写出实验步骤:
| ||
| △ |
(5)制得元素Y的单质,若收集到标准状况下6.72LY单质气体,至少需要多少克化合物D?同时生成氯化物的物质的量为多少mol?(用涉及到的化学式写出计算步骤)
已知:A、D、E、X、Y、Z是原子序数依次增大的短周期主族元素.A能形成密度最小的气体单质,D元素某种单质的硬度最大,X是地壳中含量最多的元素,Y的气态氢化物有臭鸡蛋气味,氧化物能使品红溶液褪色.H、W是常见金属,其元素的含量分别位于地壳中金属元素含量的第一、第二位.
(1)H能与具有磁性的W的化合物发生反应,在工业上有重要应用.写出该反应的化学方程式
(2)甲由A、E两种元素组成,分子中含有18个电子,只存在共价单键,常温下甲是一种无色液体.甲在碱性溶液中能够将CuO还原为Cu2O,已知当1mol甲完全参加反应时转移了4mol电子,则该反应的化学方程式可表示为
(3)由钠和X、Z三种元素组成的一种阴、阳离子个数之比为1:1的化合物乙,是84消毒液的主要成分,该化合物所含的化学键类型有
(4)已知W3+的浓度为0.04mol/L,室温下W(OH)3的Ksp=4×10-38,要使W3+开始形成沉淀的最小pH是
查看习题详情和答案>>
(1)H能与具有磁性的W的化合物发生反应,在工业上有重要应用.写出该反应的化学方程式
8Al+3Fe2O3
4Al2O3+9Fe
| ||
8Al+3Fe2O3
4Al2O3+9Fe
.
| ||
(2)甲由A、E两种元素组成,分子中含有18个电子,只存在共价单键,常温下甲是一种无色液体.甲在碱性溶液中能够将CuO还原为Cu2O,已知当1mol甲完全参加反应时转移了4mol电子,则该反应的化学方程式可表示为
N2H4+4CuO═N2+2Cu2O+2H2O
N2H4+4CuO═N2+2Cu2O+2H2O
.(3)由钠和X、Z三种元素组成的一种阴、阳离子个数之比为1:1的化合物乙,是84消毒液的主要成分,该化合物所含的化学键类型有
离子键、极性共价键
离子键、极性共价键
.(4)已知W3+的浓度为0.04mol/L,室温下W(OH)3的Ksp=4×10-38,要使W3+开始形成沉淀的最小pH是
2
2
.已知:A、D、E、X、Y、Z是原子序数依次增大的短周期主族元素.A能形成密度最小的气体单质,D元素某种单质的硬度最大,X是地壳中含量最多的元素,Y的气态氢化物有臭鸡蛋气味,其氧化物能使品红溶液褪色,H、W是常见金属,其元素的含量分别位于地壳中金属元素含量的第一、第二位.
(1)W元素在周期表中的位置为 ;H能与具有磁性的W的化合物发生反应,在工业上有重要应用.写出该反应的化学方程式 .
(2)A、E两种元素组成的某种气体分子,一个分子中含有10个电子,实验室制取该气体的化学反应方程式为: .
(3)甲由A、E两种元素组成,分子中含有18个电子,只存在共价单键,常温下甲是一种无色液体.甲在碱性溶液中能够将CuO还原为CH2O,已知当1mol甲完全参加反应时转移了4mol电子,则该反应的化学方程式可表示为: .
(4)处理含DX、YX2烟道气污染的一种方法,是在催化剂作用下使两者反应,产物之一为单质Y.已知反应生成1gY固体单质时放出8.4kJ热量.此反应的热化学方程式为 .
(5)由钠和X、Z三种元素组成的一种阴、阳离子个数之比为1:1的化合物乙,是84消毒液的主要成分,其溶液显碱性,原因是 .(用离子方程式表示)该化合物所含的化学键类型有 .
(6)已知:W3+的浓度为0.04mol/L,室温下W(OH)3的Ksp=4×10-38,要使W3+开始形成沉淀的最小pH是 .
查看习题详情和答案>>
(1)W元素在周期表中的位置为
(2)A、E两种元素组成的某种气体分子,一个分子中含有10个电子,实验室制取该气体的化学反应方程式为:
(3)甲由A、E两种元素组成,分子中含有18个电子,只存在共价单键,常温下甲是一种无色液体.甲在碱性溶液中能够将CuO还原为CH2O,已知当1mol甲完全参加反应时转移了4mol电子,则该反应的化学方程式可表示为:
(4)处理含DX、YX2烟道气污染的一种方法,是在催化剂作用下使两者反应,产物之一为单质Y.已知反应生成1gY固体单质时放出8.4kJ热量.此反应的热化学方程式为
(5)由钠和X、Z三种元素组成的一种阴、阳离子个数之比为1:1的化合物乙,是84消毒液的主要成分,其溶液显碱性,原因是
(6)已知:W3+的浓度为0.04mol/L,室温下W(OH)3的Ksp=4×10-38,要使W3+开始形成沉淀的最小pH是
 已知X、Y、Z、W四种短周期元素的原子半径依次减小.在周期表中X与Y、Y与Z均位同一周期的相邻位置;X的最外层电子数为次外层电子数的2倍;W分别能与X、Y、Z按一定原子数比形成电子总数为10的常见化合物.请判断X、Y、Z、W四种元素并回答下列问题:(要求用确定后的元素符号及有关化学用语表示)
已知X、Y、Z、W四种短周期元素的原子半径依次减小.在周期表中X与Y、Y与Z均位同一周期的相邻位置;X的最外层电子数为次外层电子数的2倍;W分别能与X、Y、Z按一定原子数比形成电子总数为10的常见化合物.请判断X、Y、Z、W四种元素并回答下列问题:(要求用确定后的元素符号及有关化学用语表示)(1)(XY)2分子中所有原子最外层都满足8电子,请写出其结构式:
(2)已知乙炔在一定条件下可以三聚生成苯:
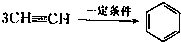 三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式:
三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式:(3)三聚氰胺遇强簸或强碱水溶液发生水解,氨基逐步被羟基取代生成三聚氰酸.三聚氰胺由于含氮量高而被一些奶粉厂家非法掺人奶粉中以提高其产品的含氮量(俗称蛋白精),经研究表明三聚氰胺和三聚氰酸在肾细胞中结合沉积从而形成肾结石,堵塞肾小管,最终造成肾衰竭,严重则危及生命.试写出三聚氰胺生成三聚氰酸的化学方程式:
(4)低碳经济是以低能耗、低污染、低排放为基础的经济模式,其中一种技术是将XZ2转化成有机物实现碳循环.如:2XZ2(g)+2W2Z(l)═X2W4(g)+3Z2(g)△H=+1411.0kJ/mol;2XZ2(g)+3W2Z(l)═X2W5ZW(l)+3Z2(g)△H=+1366.8kJ/mol则由X2W4水化制X2W5ZW反应的热化学方程式为
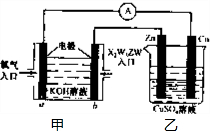
(5)利用X2W5ZW燃料电池设计如图所示的装置:
①则该装置中Cu极为
②写出b极的电极反应式为
③当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为
