摘要:21.工业上电解质量分数为23.4%的精制食盐水a kg.电解后残液的密度为ρ kg/L.将产生的H2.Cl2在一定条件下反应制成质量分数为36.5%的盐酸b kg.已知H2.C12的利用率均为c%.试计算(用含题中字母的代数式表示): (1)制得氯化氢 mol. (2)残液中氯化钠的质量 Kg. (3)残液中氢氧化钠的物质的量浓度 mol/L.
网址:http://m.1010jiajiao.com/timu3_id_396436[举报]
工业上电解质量分数为23.4%的精制食盐水a kg,电解后残液的密度为ρ kg/L.将产生的H2、Cl2在一定条件下反应制成质量分数为36.5%的盐酸b kg,已知H2、C12的利用率均为c%.试计算(用含题中字母的代数式表示):
(1)制得氯化氢
(2)残液中氯化钠的质量
(3)残液中氢氧化钠的物质的量浓度
mol/L.
查看习题详情和答案>>
(1)制得氯化氢
10b
10b
mol.(2)残液中氯化钠的质量
(0.234a-
)
| 58.5b |
| c |
(0.234a-
)
Kg.| 58.5b |
| c |
(3)残液中氢氧化钠的物质的量浓度
| 1000ρb |
| ac-36.5b |
| 1000ρb |
| ac-36.5b |
工业上电解质量分数为23.4%的精制食盐水a kg,电解后残液的密度为ρ kg/L.将产生的H2、Cl2在一定条件下反应制成质量分数为36.5%的盐酸b kg,已知H2、C12的利用率均为c%.试计算(用含题中字母的代数式表示):
(1)制得氯化氢______mol.
(2)残液中氯化钠的质量______ Kg.
(3)残液中氢氧化钠的物质的量浓度______mol/L.
查看习题详情和答案>>
(1)制得氯化氢______mol.
(2)残液中氯化钠的质量______ Kg.
(3)残液中氢氧化钠的物质的量浓度______mol/L.
工业上电解质量分数为23.4%的精制食盐水a kg,电解后残液的密度为ρ kg/L.将产生的H2、Cl2在一定条件下反应制成质量分数为36.5%的盐酸b kg,已知H2、C12的利用率均为c%.试计算(用含题中字母的代数式表示):
(1)制得氯化氢______mol.
(2)残液中氯化钠的质量______ Kg.
(3)残液中氢氧化钠的物质的量浓度______mol/L.
查看习题详情和答案>>
(1)制得氯化氢______mol.
(2)残液中氯化钠的质量______ Kg.
(3)残液中氢氧化钠的物质的量浓度______mol/L.
查看习题详情和答案>>
二甲醚(CH3OCH3)被称为21世纪的新型能源,是一种高效、清洁能源.
Ⅰ.工业制备二甲醚的生产流程如下:
催化反应室中(压力2.0~10.0Mpa,温度230~280℃)发生如下反应:
①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ/mol
(1)二甲醚也可以通过天然气和CO2合成制得,该反应的化学方程式为
(2)催化反应室中总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=
(3)在温度相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒压,发生反应②,测得反应达到平衡时的有关数据如下.
下列说法正确的是
A.a+2c=23.5 B.α1+α2=1 C.V1>V3 D.c1=2c3
(4)上述生产流程中,可以循环使用的物质有
Ⅱ.用二甲醚-空气碱性(KOH)燃料电池作电源电解精炼粗铜(如图),在接通电路一段时间纯Cu质量增加3.2g.

(5)请写出燃料电池中的负极反应式:
(6)燃料电池正极消耗标准状况下空气的体积是
查看习题详情和答案>>
Ⅰ.工业制备二甲醚的生产流程如下:

催化反应室中(压力2.0~10.0Mpa,温度230~280℃)发生如下反应:
①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ/mol
(1)二甲醚也可以通过天然气和CO2合成制得,该反应的化学方程式为
3CH4+CO2→2CH3OCH3
3CH4+CO2→2CH3OCH3
.(2)催化反应室中总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=
-246.1kJ/mol
-246.1kJ/mol
,830℃时反应③的K=1.0,则在催化反应室中反应③的K>
>
1.0(填“>”、“<”或“=”).(3)在温度相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒压,发生反应②,测得反应达到平衡时的有关数据如下.
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol CH3OCH3、1mol H2O | 2mol CH3OH | 1mol CH3OH |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 吸收a kJ | 放出b kJ | 放出c kJ |
| 平衡时体积(L) | V1 | V2 | V3 |
| 反应物转化率 | α 1 | α 2 | α 3 |
A、B、C
A、B、C
.(填字母序号)A.a+2c=23.5 B.α1+α2=1 C.V1>V3 D.c1=2c3
(4)上述生产流程中,可以循环使用的物质有
甲醇和水、CO和H2
甲醇和水、CO和H2
.Ⅱ.用二甲醚-空气碱性(KOH)燃料电池作电源电解精炼粗铜(如图),在接通电路一段时间纯Cu质量增加3.2g.

(5)请写出燃料电池中的负极反应式:
CH3OCH3-12e-+16OH-=2CO32-+11H2O
CH3OCH3-12e-+16OH-=2CO32-+11H2O
.(6)燃料电池正极消耗标准状况下空气的体积是
2.8L
2.8L
(空气中O2体积分数以20%计算).
二甲醚(CH3OCH3)被称为21世纪的新型能源,是一种高效、清洁能源.
Ⅰ.工业制备二甲醚的生产流程如下: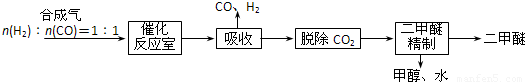
催化反应室中(压力2.0~10.0Mpa,温度230~280℃)发生如下反应:
①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ/mol
(1)二甲醚也可以通过天然气和CO2合成制得,该反应的化学方程式为______.
(2)催化反应室中总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=______,830℃时反应③的K=1.0,则在催化反应室中反应③的K______1.0(填“>”、“<”或“=”).
(3)在温度相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒压,发生反应②,测得反应达到平衡时的有关数据如下.
下列说法正确的是______.(填字母序号)
A.a+2c=23.5 B.α1+α2=1 C.V1>V3 D.c1=2c3
(4)上述生产流程中,可以循环使用的物质有______.
Ⅱ.用二甲醚-空气碱性(KOH)燃料电池作电源电解精炼粗铜(如图),在接通电路一段时间纯Cu质量增加3.2g.
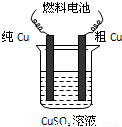
(5)请写出燃料电池中的负极反应式:______.
(6)燃料电池正极消耗标准状况下空气的体积是______(空气中O2体积分数以20%计算).
查看习题详情和答案>>
Ⅰ.工业制备二甲醚的生产流程如下:

催化反应室中(压力2.0~10.0Mpa,温度230~280℃)发生如下反应:
①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ/mol
(1)二甲醚也可以通过天然气和CO2合成制得,该反应的化学方程式为______.
(2)催化反应室中总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=______,830℃时反应③的K=1.0,则在催化反应室中反应③的K______1.0(填“>”、“<”或“=”).
(3)在温度相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒压,发生反应②,测得反应达到平衡时的有关数据如下.
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol CH3OCH3、1mol H2O | 2mol CH3OH | 1mol CH3OH |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 吸收a kJ | 放出b kJ | 放出c kJ |
| 平衡时体积(L) | V1 | V2 | V3 |
| 反应物转化率 | α 1 | α 2 | α 3 |
A.a+2c=23.5 B.α1+α2=1 C.V1>V3 D.c1=2c3
(4)上述生产流程中,可以循环使用的物质有______.
Ⅱ.用二甲醚-空气碱性(KOH)燃料电池作电源电解精炼粗铜(如图),在接通电路一段时间纯Cu质量增加3.2g.

(5)请写出燃料电池中的负极反应式:______.
(6)燃料电池正极消耗标准状况下空气的体积是______(空气中O2体积分数以20%计算).
查看习题详情和答案>>