网址:http://m.1010jiajiao.com/timu3_id_3960425[举报]
下列有关物质性质应用的说法正确的是
A.SO2具有漂白性,可用作熏蒸粉丝使其增白
B.常温下二氧化硅不与强酸反应,可用石英容器盛放氢氟酸
C.铜的金属活泼性比铁的弱,可在铁船闸上装若干铜块以减缓其腐蚀
D.氧化铝熔点很高,可用作制造高温耐火材料,如制耐火砖、坩埚等常用作催熟剂、除草剂等,实验室用卤块(主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质)制备少量Mg(ClO3)2·6H2O的流程如下:

已知:几种化合物的溶解度(S)随温度(T)变化曲线如下图所示。

(1)过滤时主要玻璃仪器有 。加入BaCl2的目的是除去杂质离子,检验已沉淀完全的方法是: 。
(3)“调节pH=4”可选用的试剂是 (填编号)
①MgO ②CuO ③稀NaOH溶液
④Mg ⑤稀硫酸 ⑥MgCO3
(4)反应II为:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:① ;②趁热过滤;③ ;④过滤、洗涤、干燥。
(5)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量m g产品配成100 mL溶液。
步骤2:取10 mL溶液于锥形瓶中,加入10 mL稀硫酸和20 mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1 K2Cr2O7标准溶液滴定未被氧化的Fe2+。记录消耗K2Cr2O7溶液的体积。
①步骤2中发生反应的离子方程式为: 。
②若配制K2Cr2O7标准溶液时未洗涤烧杯,则产品中Mg(ClO3)2·6H2O的含量会 。(填“偏高”、“偏低” 或“不变”)。
查看习题详情和答案>>
①甲基橙3.1~4.4 ②甲基红4.4~6.2 ③酚酞8.2~10)。试回答:
(1)在25℃时,1L水中约能溶解0.01g碳酸钡,则该温度下碳酸钡的溶度积 Ksp=__________。
(2)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,应选用_________指示剂,理由是_______________;判断到达滴定终点的实验现象是__________。
(3)为测定某烧碱样品中NaOH的含量(设样品中杂质为Na2CO3),某同学进行如下实验:准确称取5.0g样品配制成250mL溶液,然后分三次各取配制好的烧碱溶液20.00mL于三个用蒸馏水洗净的锥形瓶中,分别加入过量的BaCl2溶液,并向锥形瓶中各加入1~2滴指示剂,用浓度为0.2000mol·L-1的盐酸标准液进行滴定,相关数据记录如下

②滴定时的正确操作是__________。
③下列操作会导致烧碱样品中NaOH含量测定值偏高的是__________
A.锥形瓶用蒸馏水洗后未用待测液润洗
B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.在滴定前有气泡,滴定后气泡消失
D.滴定前平视读数,滴定结束俯视读数
(1)在25℃时,1L水中约能溶解0.01g碳酸钡,则该温度下碳酸钡的溶度积 Ksp=________。
(2)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,应选用__________指示剂,理由是______________________;判断到达滴定终点的实验现象是________________________。
(3)为测定某烧碱样品中NaOH的含量(设样品中杂质为Na2CO3),某同学进行如下实验:准确称取5.0g样品配制成250mL溶液,然后分三次各取配制好的烧碱溶液20.00mL于三个用蒸馏水洗净的锥形瓶中,分别加入过量的BaCl2溶液,并向锥形瓶中各加入1~2滴指示剂,用浓度为0.2000mol·L-1的盐酸标准液进行滴定,相关数据记录如下:

②滴定时的正确操作是________________________________。
③下列操作会导致烧碱样品中NaOH含量测定值偏高的是____________。
A.锥形瓶用蒸馏水洗后未用待测液润洗
B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.在滴定前有气泡,滴定后气泡消失
D.滴定前平视读数,滴定结束俯视读数
A.测溶液pH的方法是:取一小片广泛pH试纸置于玻璃片或表面皿上,再用干燥、洁净的玻璃棒蘸取溶液,点在pH试纸中部,然后跟标准比色卡比较
B.在测定硫酸铜晶体结晶水含量的实验中,下列操作都会导致测定结果偏高:①加热前称量容器时,容器未完全干燥 ②加热过程中有少量晶体溅出 ③加热后容器未放入干燥器中冷却
C.配制0.1 mol·L-1的NaCl溶液250 mL,烧杯、玻璃棒、250 mL的容量瓶、胶头滴管等玻璃仪器必须用到
D.用50 mL酸式滴定管量取25.00 mL稀盐酸的操作可以是:先将稀盐酸注入酸式滴定管,调节其凹液面正好与25 mL该度相切,然后将溶液全部放入50 mL锥形瓶中
E.硝酸钾溶解度测定的实验中,温度计的水银球应处于烧杯中的水浴液面以下;分馏石油时,温度计的水银球应处于蒸馏烧瓶的支管口处
F.仪器洗涤中常采用下列方法:①用酒精清洗制取酚醛树脂用过的大试管 ②用氨水清洗做过银镜反应的试管 ③用浓盐酸稍加热清洗用高锰酸钾制氧气后的试管
(2)实验室里化学试剂的保存方法是不相同的,下图中A、B、C、D、E是常见的一些保存药品的试剂瓶。请把下列常见试剂的序号填写在各试剂瓶下方的括号里:
①浓硫酸 ②碳酸钾溶液 ③碱石灰 ④四氯化碳 ⑤氯水 ⑥浓硝酸 ⑦硝酸银溶液 ⑧金属钠
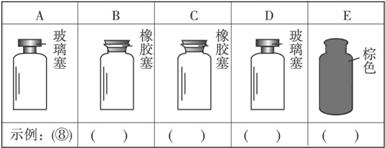
①石蕊试纸(检验气体):_________________________________。
②容量瓶:___________________________________________________。
③托盘天平:___________________________________________________。
(2)实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:先配制100 mL 0.10 mol·L-1NaOH 标准溶液,然后取20.00 mL待测稀盐酸溶液放入锥形瓶中,并滴加2—3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作3次,记录数据如下。
实验编号 | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.02 | 20.00 |
2 | 0.10 | 21.92 | 20.00 |
3 | 0.10 | 22.06 | 20.00 |
①滴定达到终点的标志是___________________________________。
②根据上述数据,可计算出该盐酸的浓度____________________________________。
③排去碱式滴定管中气泡的方法应采用操作__________________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有__________________(多选扣分)。
A.滴定终点读数时俯视读数
B.碱式滴定管尖嘴部分有气泡,滴定后消失
C.锥形瓶水洗后未干燥
D.锥形瓶水洗后用待测稀盐酸溶液润洗
E.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
查看习题详情和答案>>